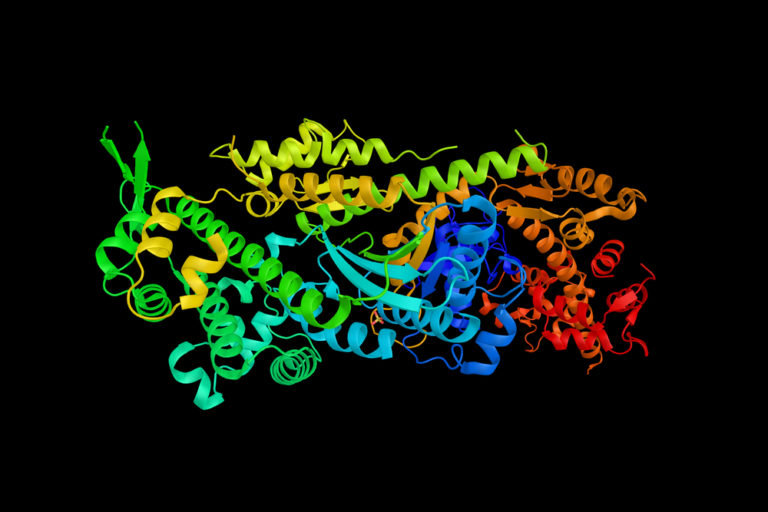
Визуализация из почти 100 тыс. изображений, полученных с помощью электронного микроскопа, показала изобретательный способ отключения белка миозина для сохранения энергии. Он участвует в мышечной активности. Подробности исследования сообщает журнал Nature.
Миозин взаимодействует с другими белками и молекулами для движения человека. Он находится внутри мышечных волокон, где образует длинные миозиновые нити, состоящие из сотен отдельных молекул белка. Когда мышечная активность прекращается, процесс формирования миозиновых нитей идет в обратном направлении: филаменты возвращаются в индивидуальное состояние молекулы миозина.
Визуализация, разработанная учеными из Университета Лидса в Великобритании и Университета Восточной Каролины в США, показала, как в таком случае меняется структура молекулы. Она складывается и становится более компактной.
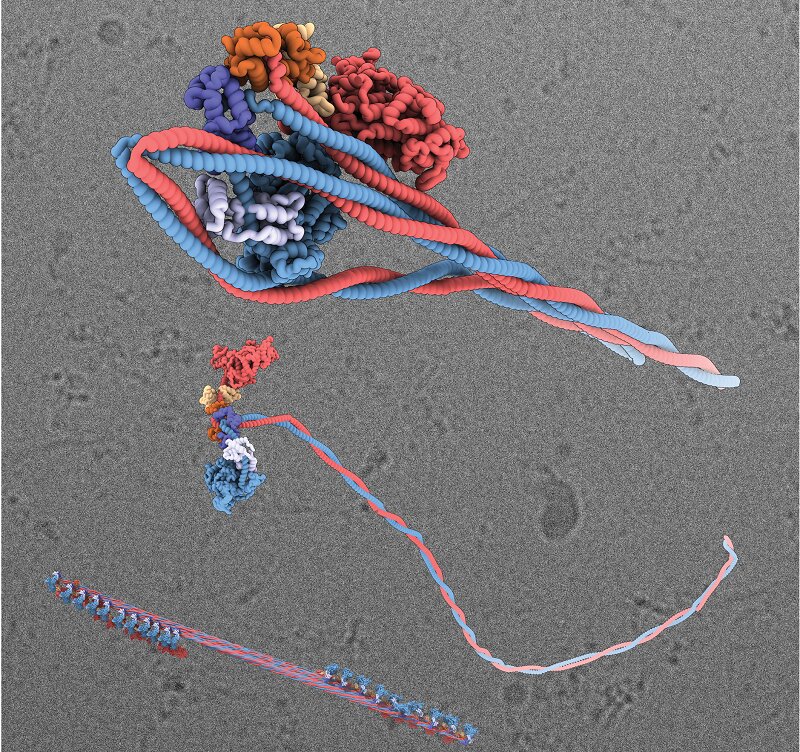
Отдельная молекула миозина состоит из «головы» и «хвоста». В активном состоянии хвосты молекул объединяются, образуя волокнистые миозиновые нити. Головки внутри филамента связываются с другим белком — актином — для сокращения мышц.
Изучив 96 тыс. изображений, полученных с помощью электронного микроскопа, ученые увидели, как молекула миозина принимает неактивную форму с беспрецедентной детализацией. Хвост каждой молекулы обвивается вокруг головы и фиксируется на месте. Этот процесс прекращает активность миозина и упрощает его транспортировку в теле человека.
Ученые десятилетиями знали о роли миозина в мышечной активности. Но до сих пор им было неясно, как именно он переходил в неактивное состояние или как его формирование так строго контролировалось.
Читать также
Найдено предполагаемое царство исчезнувших хеттов. Что обнаружили археологи?
Ледник «Судного дня» оказался опаснее, чем думали ученые. Рассказываем главное