150 лет назад родился Роберт Кох — ученый, открывший туберкулезную палочку. За свои исследования и попытки найти лекарство против туберкулеза он получил Нобелевскую премию по физиологии и медицине в 1905 году. Прошло более века, открыты вакцины и антибиотики, а туберкулез по-прежнему остается опаснейшим заболеванием, от которого, по данным ВОЗ, ежегодно умирает 1,8 млн человек. Главными «пособниками» распространения этой опасной болезни становятся генные мутации в микобактериях, их устойчивость к антибиотикам и антипрививочные движения, набирающие популярность в мире. К юбилею Коха «Хайтек» изучил спектр мутаций микобактерий туберкулеза, современные способы диагностики и проблемы в создании новых лекарств.
В 1890 году Роберт Кох объявил, что после долгих исследований нашел способ борьбы с открытой им палочкой — туберкулин. Это вещество, которое так и не стали применять на практике из-за отсутствия должного терапевтического эффекта. А в 1919 году микробиолог Альбер Кальметт и ветеринарный врач Камиль Герен создали первый штамм микобактерии туберкулеза для вакцинации людей — бациллу Кальметта — Герена (Bacilles Calmette-Guerin, BCG или БЦЖ — «Хайтек»). Впервые вакцина БЦЖ была введена новорожденному ребенку в 1921 году. Такая практика продолжается и сейчас, несмотря на антипрививочные настроения, широко распространенные сегодня по всему миру.
В наше время туберкулез — основная причина смертности прежде всего в развивающихся странах. От него умирает больше людей, чем от других инфекций, включая СПИД и заболевания, сопровождающие ВИЧ.

Что такое туберкулез ?
Туберкулез — болезнь, известная человечеству еще за два тысячелетия до начала нашей эры. Впервые его симптомы были описаны Гиппократом и Авиценной. От старого названия — чахотка (phthisis на греческом языке — «Хайтек») — образовалось понятие «фтизиатрия». Туберкулез — инфекционное заболевание, это значит, что им можно заразиться. В большинстве случаев он поражает легочную ткань, но известны случаи распространения на другие органы и ткани.
При попадании в человеческий организм возбудитель туберкулеза нарушает работу иммунной системы. Небольшие очаги поражения начинают образовываться в легких и лимфатических узлах. Так проявляется первичный туберкулез. Далее на месте очагов появляются рубцы, но сами бактерии не погибают, скорее, они напоминают «спящий» вулкан. В любой благоприятной для палочек Коха обстановке бактерии пробуждаются и набрасываются на организм с новой силой, выходя за пределы исходного очага. В активном состоянии возбудители туберкулеза хорошо размножаются в легочной ткани, разрушая сами легкие и «отравляя» весь организм в целом. Попадая в кровь и лимфу, инфекция способна распространиться по всему организму. В таких случаях речь идет уже о вторичном туберкулезе.
Пока имеются на земле трущобы, куда не проникает луч солнца, чахотка и дальше будет существовать. Солнечные лучи — смерть для бацилл туберкулеза. Я предпринял свои исследования в интересах людей. Ради этого я трудился. Надеюсь, что мои труды помогут врачам провести планомерную борьбу с этим страшным бичом человечества.

Роберт Кох
В медицине выделяют открытую и закрытую формы туберкулеза: БК+ и БК–. Открытая форма заразна, пациенты с этим диагнозом остаются в стационаре до момента исключения риска заражения здоровых людей. При открытой форме или в случаях бактериовыделения в мокроте больного обнаруживаются палочки Коха, наблюдаются некротические изменения и казеоз — туберкулезный гной.
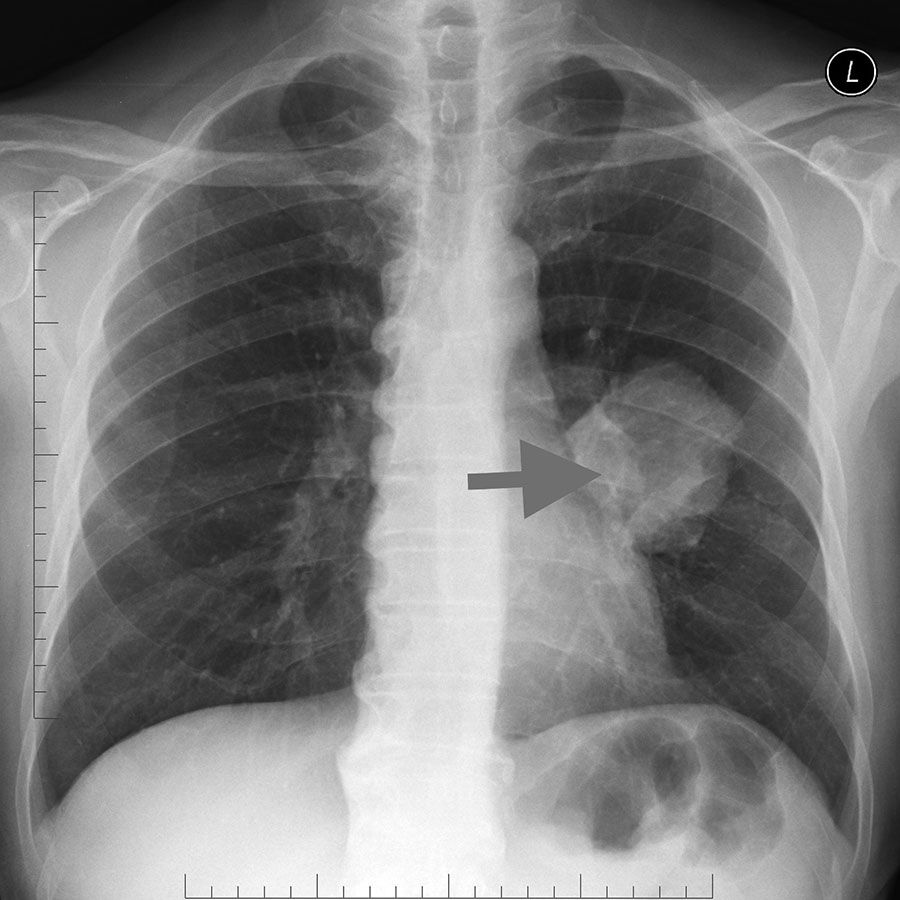
Закрытый туберкулез определить непросто, поэтому он требует специфической диагностики. Эта форма не опасна для окружающих и хорошо поддается лечению при своевременном обнаружении. При открытой форме люди всегда жалуются на кашель, повышение температуры, слабость и потливость. Возможно кровохарканье. Открытая форма туберкулеза может быть вылечена при строгом соблюдении рекомендаций врача и своевременном начале лечения.
«Чума XXI века»
Благодаря Коху туберкулез из смертоносной чахотки превратился в хроническую болезнь, с которой, даже заразившись, при применении терапии и мониторинге заболевания с помощью флюорографии грудной клетки можно прожить долго. Изначально спектр диагностики туберкулеза включал в себя поиск непосредственно самого возбудителя микроскопией мазка мокроты и определением специфических противотуберкулезных антител в крови. Сегодня существуют различные современные, высокотехнологичные методы. Например, метод генетической идентификации микобактерий туберкулеза.
В последние годы активно развиваются технологии секвенирования и мультиплексного молекулярно-генетического анализа: мультиплексная ПЦР (полимеразная цепная реакция — «Хайтек»), ПЦР в режиме реального времени, ПЦР с дальнейшей гибридизацией на биочипах различного типа.
Секвенирование в основном используется в научных исследованиях, так как для практического применения в клинических лабораториях эта технология сложна. Кроме того, стоит такая методика дорого, а результаты могут быть ложными.
Разнообразие форм устойчивости и наличие штаммов, резистентных одновременно к нескольким препаратам, требуют развития технологий мультианализа микобактерий туберкулеза на биочипах для ускоренного обнаружения возбудителя и определения его устойчивости к антибиотикам как первого, так и второго ряда в одном анализе. Мультиплексный анализ на биочипах выявляет десятки, сотни и даже тысячи видоспецифичных генетических последовательностей, а также генетических вариаций, определяющих резистентность микобактерий к антибактериальной терапии.
Туберкулез поражает преимущественно взрослых людей в их самые продуктивные годы. Однако риску подвергаются все возрастные группы. Более 95% случаев заболевания и смерти приходится на развивающиеся страны.
У людей, инфицированных ВИЧ, вероятность развития активной формы туберкулеза возрастает в 20–30 раз. Более высокому риску развития активного туберкулеза также подвергаются люди, страдающие от других нарушений здоровья, ослабляющих иммунную систему.
В 2017 году 1 млн детей (0–14 лет) заболели туберкулезом, 230 тыс. детей (включая детей с ВИЧ-ассоциированным туберкулезом) умерли от этой болезни.
Употребление табака тоже значительно повышает риск заболевания и летального исхода. 7,9% случаев инфицирования связаны именно с курением.
В 2017 году наибольшее число новых заболевших туберкулезом пришлось на регионы Юго-Восточной Азии и западной части Тихого океана — 62%. Далее следует Африканский регион, где было зарегистрировано 25% новых случаев. 87% заболевших проживают в 30 странах с тяжелым бременем туберкулеза. На долю восьми стран — Индии, Китая, Индонезии, Филиппин, Пакистана, Нигерии, Бангладеш и Южной Африки — пришлось две трети новых случаев заболевания туберкулезом.
В истории России и СССР самым благополучным был период 1970–1980 годов. В Советском Союзе проводились регулярные осмотры, лечение продолжалось вплоть до полного выздоровления, действовало множество противотуберкулезных санаториев. По словам экспертов, в конце 1970-х преподавателю медицинского института сложно было найти ребенка, больного туберкулезом, чтобы показать студентам.К 1990 году были достигнуты лучшие результаты в истории страны. Затем заболеваемость в России поползла вверх и за следующие десять лет выросла втрое. Сказались социально-экономические потрясения, потеря контроля над болезнью, миграционные процессы. Пик заболеваемости пришелся на 2002 год, а пик смертности — на 2005 год.Сейчас идет постепенный спад эпидемии. По словам президента Российского общества фтизиатров Ирины Васильевой, в 2017 году Россия даже перевыполнила рекомендованные показатели ВОЗ по снижению смертности от туберкулеза. Общая заболеваемость уменьшилась по сравнению с 2016 годом на 9,4%, смертность — на 17,9% (в мире снижение этих показателе составило 1,5–2%). Но показатели смертности от туберкулеза в России все равно высоки и «сильно отличаются от европейских»: в прошлом году заболеваемость туберкулезом составила 48,3 случая на 100 тыс. населения, смертность — 6,2 на 100 тыс.
Болезнь не отступает
Сегодня на рассмотрении в российском правительстве находится проект Государственной стратегии ликвидации туберкулеза к 2030 году. Никто не надеется, что к этому времени вообще не будет больных, речь идет о том, чтобы проблема перестала быть глобальной, объясняют специалисты. Особенно в свете проблем, с которыми столкнулись фтизиатры — множественной лекарственной устойчивостью микобактерий туберкулеза (МЛУ) и его сочетанием с ВИЧ-инфекцией.
Рост МЛУ — общемировая проблема. Если в 2009 году среди российских пациентов, выделяющих микробактерии туберкулеза, МЛУ-формы встречались в 10,5% случаев, то в 2017-м — уже в 54%. Среди инфицированных детей встречается в 40% случаев. Если у взрослых устойчивость развивается при нарушении назначенного режима и дозы препаратов или прерывании лечения, то дети сразу инфицируются уже резистентной к лекарствам бактерией. И если не остановить распространение МЛУ-туберкулеза от взрослых к детям, то инфицированные дети через 10–20 лет могут заболеть этой формой.
Сегодня улучшается молекулярно-генетическая диагностика заболевания, появляются быстрые (1,5–2 дня) тесты на лекарственную устойчивость возбудителя. В проекте Стратегии ставится цель охватить такими тестами до начала лечения 97% пациентов.Вторая основная проблема современной фтизиатрии связана с тем, что сегодня 21% больных, впервые попадающих на учет по туберкулезу, ВИЧ-инфицированы. И их доля продолжит расти, констатируют специалисты: у людей с вирусом иммунодефицита риск заражения туберкулезом повышен в 30–40 раз. Кроме того, медики недостаточно следят за детьми, которые родились без ВИЧ от инфицированных матерей.
Усугубляют ситуацию и антипрививочные настроения в обществе: большое число здоровых женщин, родивших здоровых детей, отказываются от их вакцинации. На сегодняшний день выписываются из роддомов с прививками лишь 80% новорожденных (необходимо 95%). В итоге среди детей до года, заболевших туберкулезом, около 41% не имели прививки БЦЖ. Всего же в прошлом году в России диагноз туберкулез был поставлен 300 детям до трех лет, 22% из них не были привиты.
Антивакцинаторство или антипрививочное движение — общественное движение, оспаривающее эффективность, безопасность и правомерность вакцинации, в частности массовой. Согласно заключению экспертов ВОЗ, большинство доводов антивакцинаторов не подтверждается научными данными и характеризуется как «тревожное и опасное заблуждение».
С конца 80-х годов ХХ века, после публичных выступлений и публикаций вирусолога Червонской, руководителя Центра естественного родительства Цареградской и гомеопата Котока, в России стали распространяться мнения о вреде прививок. Они, в частности, состояли в том, что «негативные последствия вакцинации могут быть опаснее самих инфекций», особенно для грудных детей. Начались отказы от прививок.
Палочка-мутант
Ученые из Института общей генетики имени Н. И. Вавилова РАН и МФТИ создали каталог мутационных изменений в 319 генах вирулентности микобактерий, вызывающих туберкулез. Эти гены кодируют белки, ответственные за преодоление иммунного ответа у человека. Последующий анализ выявил набор из трех мутаций, они могут позволить микобактериям быстро развиваться в организме людей с пониженным иммунитетом. Появление новых штаммов требует иных подходов к лечению и предполагает разработку новых генно-инженерных вакцин, эффективных с точки зрения иммунного состояния конкретного пациента и особенностей вирулентности патогена.
Валерий Даниленко, заведующий отделом генетических основ биотехнологий ИОГен имени Н.И. Вавилова РАН, предупреждает: «Человечество пытается опередить болезнь с помощью новых препаратов и технологий для лечения, однако эта борьба тактически уже проиграна. За 50 лет был создан только один новый антибиотик — бедаквилин — с новым механизмом действия. Он используется где-то два года. Но у микобактерий уже появились мутации устойчивости к нему».
Новые штаммы бактерии с измененной вирулентностью уже «почувствовали» слабость человечества в плане наличия людей с пониженным иммунитетом в популяции. Именно на такие группы нацелена сейчас экспансия штаммов с новыми мутациями вирулентности, а также обладающих лекарственной устойчивостью.
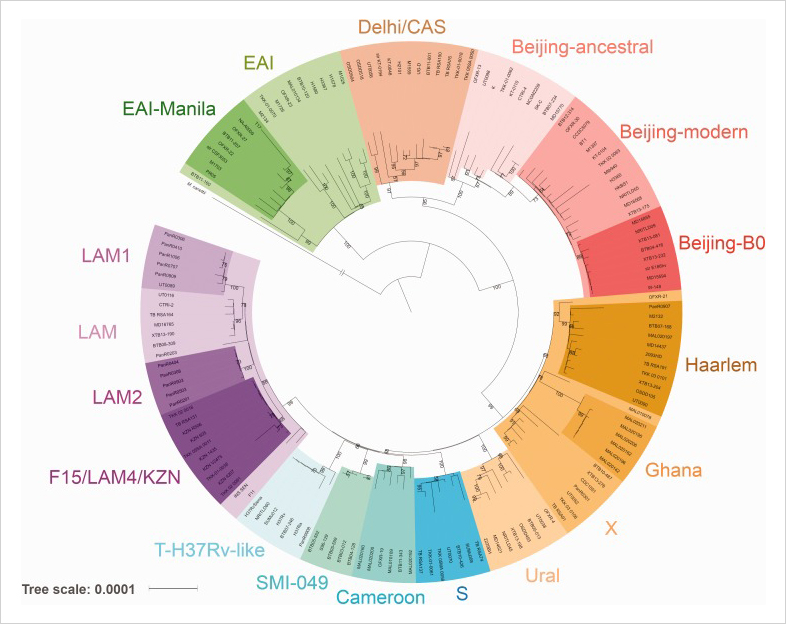
На данный момент исследователи выделяют семь-восемь основных линий микобактерий туберкулеза, которые отличаются друг от друга наличием мутаций в разных генах. Таких мутаций, SNP (мутаций в конкретном гене за счет замены одного нуклеотида на другой — «Хайтек»), может быть от 300 до 1 тыс. на геном. Если изменения происходят в важной части гена вирулентности, то белок, кодирующий ген, вызовет другую иммунную реакцию. За счет этого бактерия может преодолевать иммунитет человека к туберкулезу, выработанный благодаря прививанию в детском возрасте БЦЖ.
Сотрудники Французского национального центра научных исследований, Лилльского университета, Института Пастера, Каролинского института и еще целого ряда научных центров нашли способ преодолеть устойчивость таких туберкулезных штаммов. Исследователи пишут, что у M. tuberculosis на самом деле есть еще один фермент, способный сделать из этионамида яд, и нужно только «разбудить» ген ethA2, в котором закодирован этот альтернативный фермент.Авторы работы описывают вещество SMARt-420 — молекулу-активатор для ethA2: эксперименты показали, что этионамид в компании с активатором эффективнее действует как на обычные штаммы туберкулезного возбудителя, так и на лекарственно-устойчивые. У мышей после такого двойного лекарства количество бактерий в легких уменьшалось в 40 тыс. раз, а уровень микробов становился таким же, как при лечении обычными противотуберкулезными антибиотиками мышей с обычными штаммами микроба.Конечно, есть вероятность, что у бактерий возникнет устойчивость и к SMARt-420. Чтобы так не случилось, авторы работы советуют использовать молекулу-активатор с перерывами. Если в бактериальной популяции и появятся клетки с новой устойчивостью, их сначала будет слишком мало, но потом, когда SMARt-420 временно исчезнет, их вытеснят обычные туберкулезные микробы. Так удастся одновременно истребить тех, кто просто нечувствителен к этионамиду и другим препаратам, и не допустить появления устойчивости «нового поколения».Впрочем, как именно лучше использовать SMARt-420, станет ясно после клинических испытаний, которые должны начаться в первой половине 2019 года.
Наночастицы против микобактерий
Компания «Центр перспективных технологий», МГУ имени М. В. Ломоносова и ЦНИИ туберкулеза участвуют в международном проекте «Мульти-ТБ» по созданию биочипа, позволяющего идентифицировать множество генов и наличие мутаций в них в одном анализе. Для этого разрабатывается комплекс диагностических тест-систем. Они способны быстро выявить микобактерии и определить на основе молекулярно-генетической и иммунологической диагностики, какие из бактерий устойчивы к антибиотикам.
Тест-системы позволят проводить комплексную диагностику в три этапа. Первый этап предполагает быстрый анализ мокроты для обнаружения микобактерии в течение нескольких минут с использованием специфических антител, меченных наночастицами золота. Для подтверждения положительных результатов будет разработана тест-система на основе биочип-картриджа, сочетающего мультианализ на биочипе и флюидные технологии. В качестве специфических реагентов для определения специфического паттерна антител пациента будут использованы белковые маркеры-антигены. Для третьего этапа диагностики разработают молекулярно-генетические методы обнаружения генетических маркеров лекарственной устойчивости микобактерий на основе мультианализа на биочипах.
Борьба с туберкулезом продолжается уже несколько веков. Пока он не побежден. Самым важным шагом на пути к окончательной капитуляции палочки является всеобщая вакцинация. Но, учитывая вышеупомянутые мутации вируса, каждому здоровому человеку следует проходить рентгенологическое исследование грудной клетки один раз в два года. Флюорография в системе профилактики позволяет начать лечение на ранних этапах заболевания, что является важным условием успешности борьбы с туберкулезом.