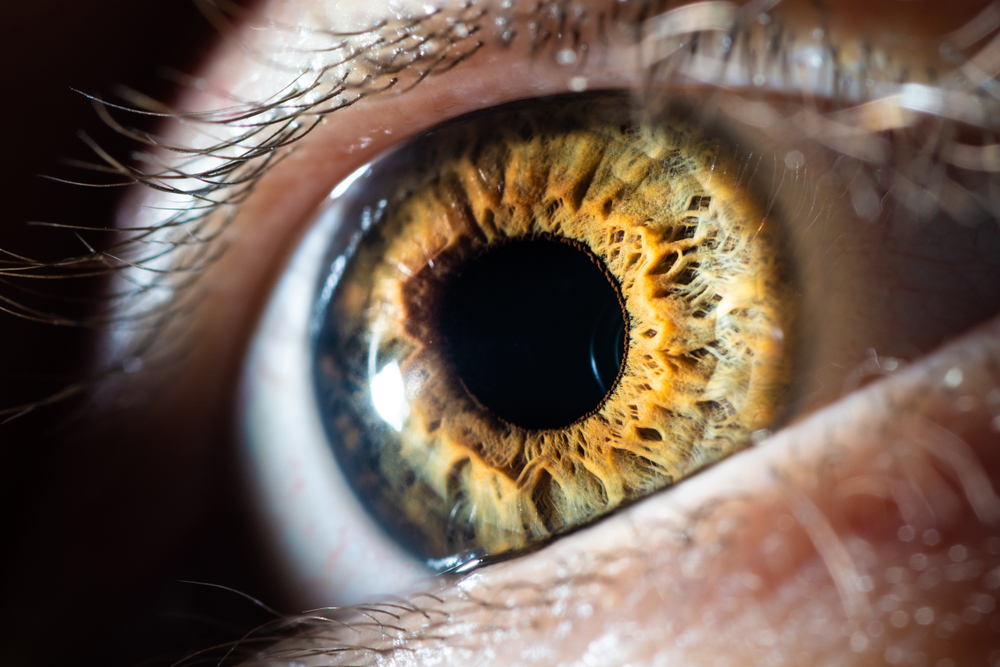
Самая сложная часть нашего глаза — сетчатка — это внутренняя оболочка глаза, ее относят к периферическому отделу зрительного анализатора. В сетчатке есть фоторецепторные клетки, которые обеспечивают и преобразование электромагнитного излучения видимой части спектра в нервные импульсы.
Сетчатка состоит из множества слоев клеток, каждый из которых по-своему важен. Наружный — пигментный эпителий — питает глаз, а также фильтрует свет, который должен поступить на светочувствительные элементы. Они, в свою очередь, преобразуют отраженный от предметов свет в сигналы для нервных клеток.
Сетчатка глаза у взрослого человека имеет диаметральный размер 22 мм и покрывает около 72% площади внутренней поверхности глазного яблока. Пигментный слой сетчатки (самый наружный) с сосудистой оболочкой глаза связан более тесно, чем с остальной частью сетчатки.
Бионические протезы глаз
Электрическая стимуляция сетчатки незрячих людей вызывает ощущение световых вспышек, которые исследователи назвали фосфен. В результате выяснилось, что клетки обрабатывают разные сигналы по-разному.
Но главное: удалось добиться более точной стимуляции, в результате которой нейроны генерировали не просто вспышки, а очертания предметов.
C 2002 по 2004 год исследователи имплантировали шести добровольцам с полной или частичной слепотой на один глаз бионические протезы. Первые пользователи устройства, известного как Argus I сообщили, что способны воспринимать фосфены, формы объектов и даже чувствовать движение
Возможность дать слепому человеку приобрести зрение при помощи бионического глаза зависит от обстоятельств, вызвавших потерю зрения. Протез сетчатки является наиболее распространенным зрительным протезом. Для этого протеза лучше всего подходят пациенты с потерей зрения из-за дегенерации фоторецепторов.
Шансы на успех увеличиваются, если зрительный нерв пациента был развит до появления слепоты. Люди с врожденной слепотой могут не иметь полностью развитого зрительного нерва, хотя нейропластичность позволяет нерву развиваться после установки имплантата.
Усовершенствованная модель — Argus II — была одобрена европейскими регулирующими органами в 2011 году для людей с пигментным ретинитом — группой редких генетических заболеваний, при которой отмирают светочувствительные клетки.
Чтобы установить Argus II, пациентам в глаз вживляют чип, внутри которого находится решетка из электродов. Миниатюрная видеокамера на очках посылает сигналы на специальный процессор. Он преобразует их в инструкции, которые затем передаются на имплантированное устройство по беспроводной сети. Затем электроды стимулируют нервные клетки в передней части сетчатки.
В результате люди могут различать объекты с высококонтрастными краями, такие как двери или окна. А кто-то — даже расшифровывать крупные буквы на стендах.
Генная терапия для зрения
Бывают случаи, когда слепота вызвана мутацией в каком-то гене, тогда можно попробовать воздействовать конкретно на него.
Такую операцию ученые делают с помощью вируса: выключает дефектную копию гена в организме и заменяет ее на здоровую, которая будет выполнять нужные функции.
Вирус создают в лаборатории таким образом, чтобы он доставлял нужный ген прямо в клетки, не принося им вреда, и вводят в орган.
Впервые такой метод лечения применили на людях с наследственной атрофией зрительного нерва из-за мутации в гене RPE65. В этом случае в раннем возрасте развивается куриная слепота, а позже может произойти обширная потеря зрения.
Клинические испытания III фазы в 2017 году увенчались успехом: люди с почти полной потерей зрения после лечения могли лучше видеть препятствия и обходить их. В декабре того же года терапия получила одобрение американского регуляторного органа.
Но пока что это небольшое достижение, для излечения нужно заменить только одну копию дефектного гена, но в большинстве случаев простое добавление нормальной копии гена не поможет. Необходимо буквально выключить мутировавший ген.
Генная терапия также бесполезна на поздних стадиях болезни, при которой сетчатка почти уничтожена.
Оптогенетика для ранней стадии развития болезней
Оптогенетика — это методика исследования работы нервных клеток, она основана на внедрении в их мембрану специальных каналов — опсинов, реагирующих на возбуждение светом.
Если на мозг воздействовать светом с определенной длиной волны, то те нейроны, которые имеют такие каналы, будут активироваться или, наоборот, не смогут генерировать потенциалы действия.
Для экспрессии каналов используются методы генной инженерии, для последующей активации либо ингибирования нейронов и нервных сетей используются лазеры, оптоволокно и другая оптическая аппаратура.
Преимущество оптогенетических методов перед традиционными электрофизиологическими методами состоит в том, что можно провести высокоселективную активацию либо подавить конкретные нейрональные связи.
В оптогенетике вирус доставляет в клетки глаза гены, которые позволяют им производить светочувствительные белки — опсины.
Рост опсинов может восстановить некоторую светочувствительность поврежденных фоторецепторов или даже сделать чувствительными к свету те клетки, которым обычно эта функция не свойственна.
Несколько лет назад ученым удалось восстановить светочувствительность клеток (колбочек), пораженных пигментным ретинитом, у мышей. Конечно, сами мыши не могли сообщить о результатах, но исследователи смогли определить его косвенным путем — измерив активность нервных клеток сетчатки, которые стимулируются колбочками при попадании на них света.
Улучшенный метод опробовали на человеке. В результате пациент может видеть силуэты крупных предметов и объектов. В прошлом месяце результаты испытаний этой двойной системы на одном пациенте были опубликованы в журнале Nature Medicine.
Однако лечение опсинами плохо работает в тандеме с естественным зрением и может мешать ему. В будущем ученые надеются модифицировать опсины таким образом, чтобы управлять их параметрами.
Регенерация глаза и его клеток
Это самый естественный и самый сложный способ. Для этого биоинженеры обычно берут немного живых клеток кожи и превращают их в стволовые — клетки-предшественники, из которых формируются все остальные. В биореакторе из них выращивают необходимые клетки глаза: светочувствительные или нервные, в зависимости от болезни.
В последнем исследовании, которое было опубликовано в середине августа 2021 года молекулярные биологи заявили, что вырастили из стволовых клеток миниатюрное подобие мозга и примитивный аналог глаз, которые похожи на органы зрения человека и животных.
Биологи подготовили набор химических сигналов, которые принудительно активируют гены, отвечающие за превращение стволовых клеток в заготовки нейронов и клеток глаза.
Используя эти вещества, Гопалакришнан и его команда обработали культуры стволовых клеток и проследили за их последующим ростом на протяжении двух месяцев.
Как показали последующие наблюдения, комбинация этих сигнальных молекул привела к тому, что примерно через месяц на поверхности органоидов начали формироваться структуры, похожие по облику и свойствам на так называемые глазные бокалы. Так ученые называют особую часть зародыша человека и других многоклеточных животных, внутри которой впоследствии формируется сетчатка, хрусталик и другие ткани глаза.
Еще один необычный вариант — попробовать возбудить процессы регенерации в уже имеющихся клетках. У большинства животных такой способности нет, но есть у рептилий и некоторых рыб. Томас Рех, нейробиолог из Вашингтонского университета в Сиэтле, пытается подобрать ключ к этой способности у людей. И первые результаты он уже получил.
В 2017 году они смогли заблокировать особый фермент, который блокирует их доступ к гену Ascl1 и добились того, чтобы регенерация началась и у взрослых мышей. Хотя их строение отличалось от естественных клеток, тесты показали, что новые нейроны чувствительны к свету.
Читать далее:
Япония представила новый двигатель, который позволит ракетам изучать глубокий космос
В Китае обнаружены два новых вида динозавров
Появился метод использования квантовых компьютеров в повседневных условиях