Вылечить рак на поздних стадиях, избавить ВИЧ-инфицированных от пожизненной антиретровирусной терапии, ускорить регенерацию тканей после травм и операций — это не просто глобальные задачи медицинской генетики, а реальные проекты отечественных ученых. Медицинская генетика — одна из ставок дорожной карты «Хелснет» Национальной технологической инициативы, определяющая акценты в поддержке компаний. По прогнозам экспертов НТИ, объем мирового рынка по этому направлению вырастет с $12 млрд в 2020 году до $1,2 трлн в 2035-м. Рассказываем о самых прорывных разработках в области генной терапии, которые создаются в России.
Гены-убийцы рака
В 2021 году планируется начать клинические испытания «АнтионкоРАН-М» — это первый в мире препарат генной терапии рака с невирусной системой доставки. В исследованиях первой фазы смогут принять участие пациенты с раковыми опухолями на поздних стадиях. Производство препарата осуществляется на площадке Центра им. Гамалеи.
«АнтионкоРАН-М» действует так: в опухоль доставляются так называемый ген-убийца, продукт которого уничтожает раковые клетки, и ген-иммуностимулятор. Его белок активирует противоопухолевый иммунный ответ, в результате подавляется метастазирование. Процесс происходит внутри опухоли, что снижает его токсичность для нормальных тканей и органов.
Невирусный противоопухолевый препарат потенциально безопаснее, чем вирусные препараты, объясняет один из основателей компании-разработчика препарата ООО «Генная хирургия» Максим Кокшаров. Успешные клинические испытания позволят России занять лидирующие позиции на мировом рынке генной терапии рака и в дальнейшем укрепить свое лидерство на рынке генетических технологий, уверен он.
Еще один российский препарат генной терапии рака, появления которого ждут в мире, — разработка компании «Онкостар» в партнерстве с Институтом химической биологии и фундаментальной медицины (ИХБФМ) СО РАН и центром «Вектор». Лекарство сделали на основе онколитического вируса осповакцины человека. Из генома вируса вырезали два участка, ответственные за его вирулентность, и вместо них вставили два других гена. Один из них синтезирует иммуностимулирующий белок ГМ-КСФ, а второй — белок-убийцу лактаптин, он уничтожает раковые клетки.
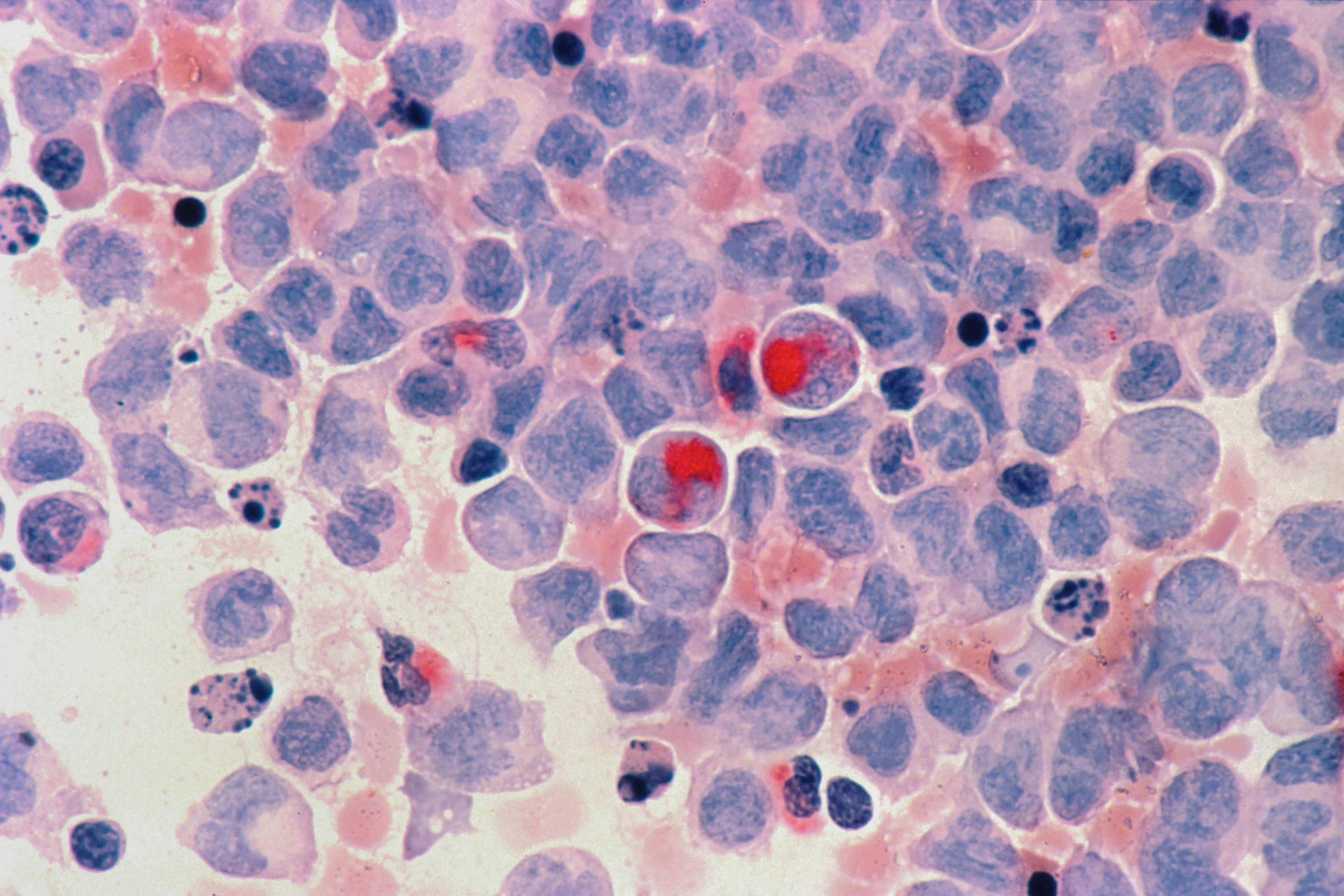
Доклинические исследования препарата прошли успешно. На проведение первой фазы клинических испытаний разработчики планируют получить частные инвестиции.
«Мы позиционируем разработку как препарат против рака молочной железы, — рассказал Владимир Рихтер, замдиректора ИХБФМ СО РАН по научной работе и один из основателей компании “Онкостар”. — Но работаем и с другими типами опухолей — главным образом это новообразования головного мозга. Пока испытания проводятся только на животных, но результаты очень обнадеживают».
Оба инновационных отечественных препарата для борьбы с раком должны появиться на рынке к 2027 году, но, возможно, это случится и раньше, так как они могут воздействовать на некоторые виды опухолей, которые считаются орфанными, и по российскому законодательству имеют право на ускоренную регистрацию — уже после второй фазы клинических исследований.
Редактирование ДНК против ВИЧ
Редактирование ДНК человека в перспективе должно избавить ВИЧ-инфицированных от пожизненной антиретровирусной терапии. Новый метод лечения ВИЧ создает резидент «Сколково», компания Advanced Gene & Cell Technologies (AGCT) — с 2016 года она работает в рамках дорожной карты «Хелснет» НТИ. В мире зарегистрированных технологий на основе редактирования ДНК пока нет.
Proof of concept — громкая берлинская история 2007 года. Тогда Тимоти Рэю Брауну, пациенту с ВИЧ, у которого к тому же выявили миелоидный лейкоз, сделали трансплантацию костного мозга. Оказалось, что у донора редкая мутация в гене CCR5, которая неожиданно вызвала у реципиента иммунитет к ВИЧ. После трансплантации «берлинский пациент» прожил еще 13 лет, за это время, несмотря на отсутствие антиретровирусной терапии, ВИЧ в его крови ни разу не обнаружили.
«Мы искусственно воспроизводим эту природную мутацию и в клетках костного мозга, — рассказала гендиректор AGCT Марина Попова. — Наш продукт — это готовые к трансплантации клетки человека. И базовая технология — аутологичная трансплантация гемопоэтических стволовых клеток (ауто-ТГСК), которая широко применяется для лечения лимфом». Уже готов прототип продукта — гемопоэтические стволовые клетки донора-добровольца с отредактированным геном CCR5, готовые к трансплантации.

Таргетная популяция для первого шага — это пациенты с лимфомами и ВИЧ, которым необходима ауто-ТГСК для лечения лимфомы. Благодаря новому методу пациенту не просто сделают ауто-ТГСК, но и отредактируют его гемопоэтические стволовые клетки. После трансплантации все клетки крови, в том числе иммунитета, будут защищены от ВИЧ и обеспечат эффективный иммунный ответ на существующий вирус без применения антиретровирусной терапии, рассчитывают разработчики.
Ген CCR5 при трансляции обеспечивает белок-рецептор на поверхности клеток крови, и этот рецептор использует ВИЧ для входа в клетку — заражения. Выключение гена проводится с помощью инструмента редактирования ДНК, который называется TALEN. Уникальный инструмент редактирования генома — запатентованная нуклеаза TALE, обладающая высокой эффективностью редактирования (нокаута гена) и благоприятным профилем безопасности по сравнению с опубликованными зарубежными научными группами или компаниями.
Особенность технологии — платформенность. Она позволяет, заменив лишь один элемент в сложной, но отработанной технологической цепи, реализовывать разработку новых продуктов генной терапии с применением редактирования генома.
Регенерация тканей
В России 2011 году зарегистрировали первый геннотерапевтический препарат для лечения ишемии нижних конечностей — «Неоваскулген». Это дало отечественным ученым возможность создавать на его основе ген-активированные материалы и регистрировать как медицинские изделия.
Поэтому в России создан первый в мире ген-активированный материал «Гистографт». Он применяется в хирургической стоматологии и челюстно-лицевой хирургии. Это средство упрощает костную пластику перед имплантацией зубов — теперь можно использовать меньше костной ткани пациента. Это делает восстановление после операции не таким болезненным, ускоряет регенерацию и позволяет получить более качественный результат.
Изделие также можно применять в травматологии и ортопедии, ЛОР-хирургии. Сейчас ведутся дополнительные контролируемые исследования, которые позволят оценить лимиты эффективности ген-активированного материала в отдельных узких показаниях для применения. Клинические исследования проходят в петербургской Военно-медицинской академии им. Кирова, Московском государственном медико-стоматологическом университете, отметил директор компании-разработчика «Гистографт» Илья Бозо.
«Сегодня, чтобы восстановить кость в одном месте, приходится вырезать кусок из другого и смешать с остеозамещающими материалами — болит в итоге везде, — говорит он. — Поэтому будущее костной пластики и вообще регенеративной медицины — за активированными материалами, способными формировать много качественной кости, которая не “рассосется”. Кроме того, ген, попадая в клетку, заставляет ее самостоятельно продуцировать белок, что ускоряет регенерацию ткани. С использованием “Гистографта” вылечили уже сотни пациентов, в том числе с ложными суставами костей конечностей».
Сейчас ген-активированный материал выпускают в виде гранул, но в дальнейшем планируется создать гель, что откроет возможность для использования малоинвазивных техник. Например, во время синус-лифтинга не придется сверлить большое костное окно, достаточно будет маленькой дырочки, куда войдет игла шприца. Другими вариантами изделий станут ген-активированная мембрана и персонализированные имплантаты, изготовленные с использованием технологий трехмерной печати.
«Гелевый материал, который сейчас проходит доклинические испытания, — это еще и возможности использования при ожогах, язвах, варикозной болезни, регенерации сосудов», — пояснил Илья Бозо.
Кадровый потенциал
Чтобы генетические технологии совершили взрывной рывок, начинать подготовку кадров нужно со школы, уверен Сергей Седых, научный сотрудник Института химической биологии и фундаментальной медицины Сибирского отделения РАН. Уже третий год в рамках Олимпиады кружкового движения НТИ проходит трек «Геномное редактирование». За это время через него прошло более 5 тыс. школьников.
«Мы работаем со школьниками с 8 класса, и тогда в 10–11 они уже мотивированы поступать на “правильные” факультеты вузов. А в университетах показываем студентам биотехнологические компании, где их ждут на работу», — отметил Седых.
Также создают сообщество молодых ученых — для налаживания научных связей и обмена опытом. В августе в Новосибирске прошла первая школа геномного редактирования. Это недельная программа, которая будет проводиться дважды в год — в августе и феврале. Бесплатное обучение смогут пройти студенты, аспиранты и молодые специалисты — медики, биологи, агрономы.

В 2017–2019 годах в НТИ появились инструменты поддержки технологических компаний «Хелснет», в том числе через венчурные фонды. Сейчас идет второй этап внедрения дорожной карты «Хелснет» (до 2025 года). Среди его задач — дальнейшее обновление нормативно-правовой базы в связи с появлением новых технологий и подходов, продолжение пилотных проектов и проведение НИОКР.
Генная терапия уже бурно развивается — ученые ставят на то, что однажды этот метод может победить раковые опухоли и даже облегчит жизнь пациентам с ВИЧ. Многие из них уже становятся доступны и обычным людям, а не только богатым. В ближайшие несколько лет появятся все новые методы терапии — и даже страшные болезни могут стать не такими уж и устрашающими.
Читать далее
Археологи объяснили, почему древний бетон до сих пор сохранился и крепче современного
Посмотрите на цифровое искусство, которое сделали на основе анализа книг Айзека Азимова
Генетики нашли у мумии из Швейцарии трех живущих сегодня родственников
