Взрослые пациенты с рецидивирующими B-клеточными лимфомами еще до недавнего времени относились к категории практически безнадежно больных. Но в Петербурге в 2022 стартует программа терапии с помощью CAR-T-клеток: когда собственные клетки человека после генной модификации способны уничтожить опухоль. Этот подход может спасти жизни тысячи людей ежегодно. «Хайтек» вместе с благотворительным фондом AdVita поговорил с Иваном Моисеевым, заместителем директора по научной работе НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, о том, как устроена разработка новых методик лечения онкологических заболеваний, кто в России это финансирует и как устроена CAR-T-терапия.

Иван Сергеевич Моисеев окончил Первый Санкт-Петербургский государственный медицинский университет им. И.П. Павлова в 2007 году. В 2010 году получил специализацию по гематологии на кафедре факультетской терапии и был принят в качестве врача-гематолога и аспиранта в НИИ онкологии, гематологии и трансплантологии имени Р. М. Горбачевой. В 2013 году защитил кандидатскую диссертацию по теме микрососудистых осложнений после трансплантации гемопоэтических стволовых клеток.
С 2013 года научные интересы сосредоточены на снижении летальности от осложнений трансплантации гемопоэтических клеток и реакции «трансплантат против хозяина». С 2015 года стал руководителем отдела гематологии и трансплантации для взрослых в НИИ ДОГиТ им. Р. М. Горбачевой. С 2017 работает в должности заместителя директора по науке НИИ ДОГиТ им. Р. М. Горбачевой. В 2019 году защитил докторскую диссертацию по теме профилактики и лечения реакции «трансплантат против хозяина». С 2021 года — профессор кафедры онкологии, гематологии и трансплантологии в университете им. И.П. Павлова.
Автор и соавтор более 100 публикаций, освещающих различные аспекты клинической гематологии и трансплантации гемопоэтических стволовых клеток. Является активным членом Европейской Ассоциации по Трансплантации Костного Мозга (EBMT) и секретарем рабочей группы по трансплантационным осложнениям.
«CAR-T применяется в тех ситуациях, когда альтернативы нет»
— В НИИ им. Горбачевой начинают внедрение нового вида терапии против онкологических заболеваний — CAR-T. Расскажите, в чем ее суть и для каких диагнозов она применяется?
— Мы прошли все валидационные этапы, и в этом году начинается клиническая апробация методики — лечение пациентов мы будем проводить в рамках совместного проекта с НМИЦ онкологии им. Н.Н. Петрова.
Технология основана на генетически модифицированных клетках самого пациента. Генетическая модификация включает в себя соединение одного белка от B-клеток человека и второго белка от T-клеток человека, а также дополнительно усиливающего белка. В природе такой тройной конструкции не существует.
Впервые эта технология была разработана в Израиле еще в начале 90-х годов, но клиническое применение нашла только в последние пять лет, потому что ключевым фактором стало наличие этого усиливающего сигнал белка, это позволило Т-клеткам заработать на полную мощность. Все остальные модификации до этого были клинически не очень эффективны.
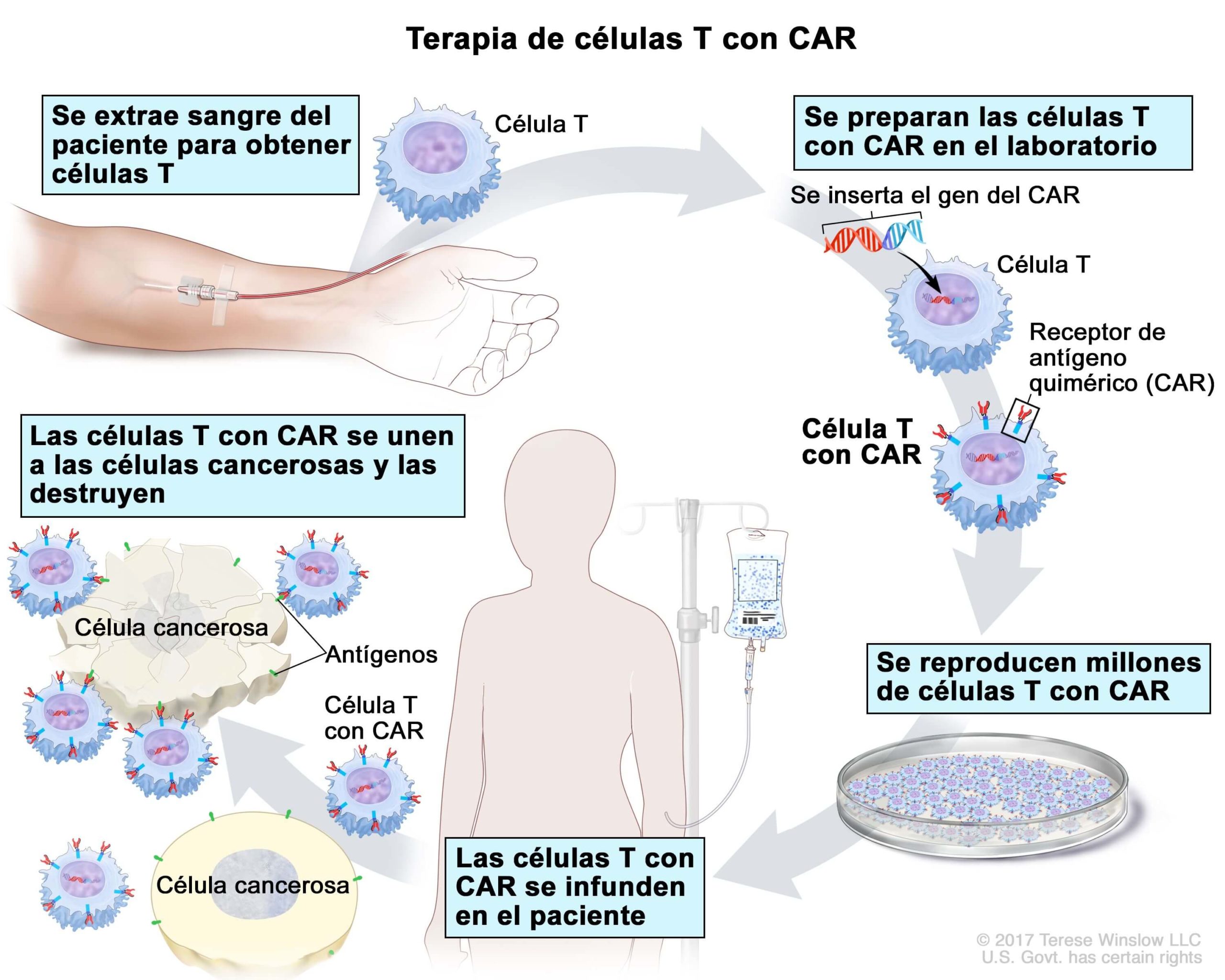
Проблема с этой терапией заключается в том, что Т-клетки, направленные против мишени, убивают целевую клетку в любом случае, даже если она нормальная и опасна только потенциально. Поэтому ограничением этой терапии на сегодняшний день является так называемый оффтаргет-эффект, когда возникает нейротоксичность в отношении нормальных тканей пациента. И здесь как раз выделяются именно B-клеточные опухоли — лейкозы и лимфомы, потому что даже если препарат уничтожит все B-клетки пациента, пациент сможет это пережить (помогут переливания крови и иммуноглобулины) и восстановиться уже здоровыми клетками.
Если говорить о солидных опухолях — например, раке желудочно-кишечного тракта, то эпителиальные клетки у человека встречаются везде. И если таргетный препарат нападет на все эпителиальные клетки организма, выльется это в токсический шок. Поэтому на сегодняшний день существует достаточно узкий спектр мишеней, при котором это возможно для текущей технологии.
Солидные опухоли — твердое четко ограниченное разрастание из собственной зрелой (дифференцированный) ткани или незрелой (зачаточный, недифференцированный) ткани. Могут появиться в любом из внутренних органов или в системах органов. Бывают доброкачественными и злокачественными.
Гемобластозы — опухолевые (неопластические) заболевания кроветворной и лимфатической ткани. Подразделяют на системные заболевания — лейкозы, а также регионарные — лимфомы.
— Для каких пациентов будет применяться это лечение?
— Наш первый этап проекта связан со взрослыми пациентами. Для детей на сегодняшний день терапия применяется в институте Димы Рогачева в Москве (НМИЦ ДГОИ им. Дмитрия Рогачева — «Хайтек»).
— Каким образом терапия вводится в организм — это инъекции, таблетка или что?
— Это небольшой пакетик для внутривенной инфузии, который обычно содержит около 100–200 миллилитров суспензии этих клеток и вводится внутривенно.
— И это разовая процедура?
— Есть описание повторных применений клеток, но они пока достаточно ограничены.
— Как повышаются шансы на успешный результат лечения при этой терапии, как меняется выживаемость пациентов?
— Терапия CAR-T применяется в тех ситуациях, когда альтернативы нет. То есть для ситуаций рецидивов и рефрактерных заболеваний. Когда другого способа получить эффект уже не существует. Поэтому с точки зрения достижения уменьшения опухолевой массы это практически жизнеспасающий метод для части пациентов, у которых как раз наблюдаются эти формы злокачественных образований. С другой стороны, сейчас уже известно, что, по крайней мере, второе поколение CAR-T-клеток требует последующего закрепления эффекта с помощью трансплантации костного мозга.
Рефрактерная форма заболевания — форма заболевания, не поддающаяся лечению (в онкологии и гематологии чаще всего имеется в виду нечувствительность к химиотерапии).
— То есть для пациентов, которым в ближайшем будущем станет назначаться этот метод, это уже последняя надежда?
— Да, фактически это так. Но нельзя сказать, что это полностью безопасный метод. Поэтому и применяется он только в тех ситуациях, когда нет других более безопасных альтернатив лечения.
— Вы уже упомянули про осложнения: как с ними будут бороться и существует ли уже соответствующая терапия?
— Нейротоксичность — не единственное осложнение терапии генно-модифицированными клетками. Существует также синдром выброса цитокинов — сейчас с приходом COVID-19 практически все знают про этот синдром. Но вообще сам термин появился в контексте клинических исследований CAR-T-клеток. До этого считалось, что это просто лихорадка, совокупность токсичности. Как отдельный синдром его выделили после того, как начались исследования CAR-T-клеток. Была выявлена четкая связь с введением клеток, сроки возникновения этих симптомов были всегда одинаковые, а симптомы имели определенный спектр.
Синдром выброса цитокинов (СВЦ) — это комплекс симптомов, которые могут развиться как побочный эффект определенных видов иммунотерапии, особенно при задействовании Т-лимфоцитов. Синдром возникает, когда иммунные клетки активируются и выбрасывают в организм значительное количество цитокинов.
Цитокины — это малые белки, работающие в качестве клеточных мессенджеров и направляющие иммунный ответ организма. Однако высокие уровни цитокинов могут спровоцировать повышенный воспалительный ответ в организме. Он может нанести вред и нарушить целый ряд функций организма. В тяжелых случаях СВЦ может привести к полиорганной недостаточности и даже смерти.
Нейротоксичность — это частный вариант синдром выброса цитокинов, при котором основой всех жизнеугрожающих проблем является увеличение проницаемости сосудов за счет избыточной продукции различных белков (вызывающих повышенный воспалительный ответ в организме) этими генно-модифицированные клетками. Конечным итогом является то, что увеличивается сосудистая проницаемость и жидкость из кровеносных сосудов переходит в органы, возникает отек, в частности отек головного мозга. Такие проблемы есть у 50–80% пациентов, в зависимости от того варианта CAR-T-клеточного конструкта, который используется в терапии. Уже есть международные рекомендации по лечению этого синдрома, определена последовательность действий для данного осложнения. В принципе, эта ситуация достаточно хорошо отработана.
«Лечение тысячи пациентов в год — четверть бюджета Петербурга на здравоохранение»
— Сколько стоит эта процедура для пациента и кто вообще это сейчас финансирует?
— На сегодняшний день в России не зарегистрировано ни одного продукта CAR-T-клеточной терапии. Предварительная оценка стоимости первого продукта, который сейчас готовит к регистрации в России иностранный производитель, — 21 млн рублей. Естественно, что никаких финансовых инструментов для того, чтобы обеспечить такое дорогостоящее лечение, пока не существует. Та программа, которая планируется у нас, это этап академического исследования, это не коммерческий продукт.
Альтернатива заводскому производству — производство CAR-T в специализированных лабораториях. По этому пути, например, пошли некоторые европейские страны, у которых нет средств платить за заводское производство. Клетки, созданные в рамках таких проектов, стоят примерно в 10 раз дешевле заводских.
Сомневаюсь, что мы получим бюджет, сопоставимый с тем, какой тратят на заводские CAR-T в США и некоторых европейских странах. Скорее всего, нам больше подходит именно вариант производства клеток в специально сертифицированных лабораториях — например, как в Испании, где разработали и применяют некоммерческий и локального производства вариант этой терапии.
Поэтому мы очень надеемся в том числе и на поддержку благотворителей для того, чтобы поддержать это исследование и обеспечить расходными материалами. В случае нашего проекта пациент не будет платить, но, с другой стороны, и государственные источники финансирования здесь невозможно привлечь из-за того, что это незарегистрированные технологии, а многие расходные материалы для производства не имеют государственной регистрации для медицинского применения.
— А если говорить о гипотетическом будущем: есть ли шанс, что государство будет как-то субсидировать для пациентов этот вид терапии?
— По-видимому, со временем появится ограниченное число квот. Но за счет существующего бюджета здравоохранения покрыть потребность для всех пациентов невозможно. К какому-то из совещаний я подсчитал, какой объем по текущим ценам потребуется. Если покупать по ценам заводских производителей, это четверть годового бюджета Петербурга на здравоохранение. Если будет принято решение о локальном производстве в специальных лабораториях — тогда да, эта терапия будет доступна для всех нуждающихся: лечение требуется примерно тысяче пациентов в год.
— Вы сказали: «тысяча пациентов в год». Это и взрослые, и дети?
— Да, дети и взрослые, но больше все-таки взрослых пациентов. Потому что лечение этих групп заболеваний у детей более эффективно, чем у взрослых. На стандартном лечении они имеют большую вероятность вылечиться полностью, а у взрослых, из-за другой биологии опухоли, вероятность полного излечения от первоначальных видов терапии существенно меньше.
«Таргетная терапия может быть менее эффективна, чем классическая химиотерапия»
— Если говорить в целом о видах терапии против онкологических заболеваний. Отходит ли сейчас медицина от химиотерапии в сторону таргетных методик?
— На самом деле, это непрерывный процесс — переход к таргетным методикам, который активно начался где-то около 10 лет назад, когда стали появляться новые препараты. В некоторых ситуациях таргетная терапия не так эффективна, как классическая химиотерапия. И нельзя сказать, что она всегда менее токсична, она имеет известный профиль осложнений, с которым понятно, как бороться.
Другое дело, что действительно есть нозологии, где успехи очень большие и где удается полностью, например, отходить от токсичных методов лечения и проводить амбулаторную терапию. Таким прорывом лет пять назад стало появление нетоксичной терапии при лимфомах. Появились ингибиторы контрольных точек, за которые в 2018 году Джеймсу Аллисону и Тасуко Хондзе дали Нобелевскую премию по медицине.
Ингибиторы контрольных точек применяются в противораковой терапии. Опухоли используют особые молекулы — именно их называют контрольными точками иммунного ответа — для того, чтобы защитить себя от действия иммунной системы организма. При помощи ингибиторов врачи активизируют иммунную систему, направляя ее клетки на борьбу с опухолями.
На сегодняшний день есть целый спектр нозологий либо генетических вариантов нозологий, которые позволяют применять этот вид лечения с излечением более половины пациентов, по крайней мере, или с достижением глубокого ответа со стороны опухоли. И при этом терапия с ингибиторами контрольных точек имеет очень ограниченные побочные эффекты, то есть это амбулаторное лечение, которое проводится раз в месяц или раз в две недели в зависимости от варианта.
— Сегодня в России пациенты могут получить таргетную терапию бесплатно?
— Да, она, как и диагностика, входит в программу обязательного медицинского страхования. Но, конечно, надо понимать, что ни одна система здравоохранения в мире не может себе позволить обеспечить всех всеми вариантами терапии. Приходится дифференцировать: где-то стохастически, то есть случайным образом, где-то учитывают пользу для здравоохранения, выбирая наиболее адекватные по соотношению затраты / полученный эффект. То есть, например, когда появились те же ингибиторы контрольных точек, в некоторых странах Европы они не прошли ценз на степень соотношения пользы и экономических затрат.
— И, получается, они не применяют эти препараты?
— В рамках программ государственного здравоохранения в некоторых странах — нет. Очень мало государств, где поддерживаются вообще все варианты терапии. Основная проблема заключается вот в чем: сейчас производителю препарата важно доказать, что препарат в принципе работает. Но на деле это значит, что срок жизни может быть продлен всего на несколько месяцев — и это все равно считается успехом клинических исследований, при этом вылечить пациента не получится. Но нельзя сказать, что системе здравоохранения выгодно заплатить 5 или 10 миллионов рублей за то, чтобы человек прожил на несколько недель дольше. Эта этическая проблема существует для всех систем здравоохранения мира, даже самых богатых.
Производителям лекарственных средств достаточно показать эту разницу между плацебо и лекарственным препаратом в отношении какой-то нозологии, чтобы получить регистрационные удостоверения и начать продавать препарат. Академическое сообщество, со своей стороны, пытается именно вылечить пациента. И для того, чтобы это сделать, нужен целый комплекс мер.
В последней лекции, которую я готовил, мы это назвали «траекторией пациента» по существующим методам лечения. Она необходима для того, чтобы определить биологические свойства его опухоли, к каким потенциальным препаратам она может быть чувствительна, какие комбинации и какие последовательно методы лечения применять. Это все, чем фармакологические компании сегодня не занимаются.
— А в России такие исследования проводятся?
— Да, конечно, в том числе НИИ им. Горбачевой проводит достаточно большое количество таких исследований: и отдельно у нас, и в кооперации с другими онкологическими центрами.
«Это утопия — история, что мы всем можем себя обеспечивать»
— А где, если говорить о географии, производятся препараты для таргетной терапии? В России фарма этим занимается?
— Вообще вышел закон о том, что все зарубежные препараты должны фасоваться в Российской Федерации. Поэтому формально мы неплохо все производим сами. Другое дело, что сама субстанция производится вне России. И надо понимать, что вообще ни одна страна мира полностью не обеспечивает себя произведенными внутри государства лекарствами, поэтому это утопия — история, что мы всем можем себя обеспечивать. В любом случае это конкурентная среда, и какие-то препараты разрабатываются и производятся в одной стране, какие-то — в другой. И очень важно, чтобы был свободный доступ ко всем методам лечения. Проблема заградительных мер выливается в то, что медицинский туризм в Турцию на 30% дешевле, чем в Россию. Просто потому что все ввозимые препараты в нашу страну проходят через стадию таможенных пошлин, а в Турции такого нет.
— А если все-таки про производство: мы способны производить такие препараты? Возможна ли такая ситуация, что какая-нибудь клиника в США будет применять наш таргетный препарат?
— Ну пока этого не произошло. Но сейчас есть несколько хороших примеров на этапе клинических исследований, могу сказать, что таких примеров до 10 в России.
— Но это лучше, чем ноль. А если возвращаться к заградительным мерам: как вы относитесь к правилу «второй лишний»? Как оно может повлиять, прежде всего, на пациентов и на уровень доверия к нашей медицине?
— Могу сказать, что уровень доверия все-таки растет, в том числе со стороны медицинского туризма, например, у нас, например, в прошлом году появился пациент из Китая. Но я не противник дженериков или биоаналогов, в особенности если они качественно сделаны. Мы много лет работаем с дженериками и от большинства препаратов ничего плохого с точки зрения побочных эффектов не видели. Другое дело, что эффективность зачастую существенно меньше, но доказать это невозможно. Поэтому в том числе и наша клиника активно участвует в программах, когда мы пытаемся привлечь внимание правительства к проблемам лечения детей, применению препаратов-дженериков для детей с онкологическими заболеваниями. Иногда такие замены сопровождаются некоторым ухудшением результатов лечения, но нет механизмов вывода некачественных дженериков с рынка.
— Но я так понимаю, что при правиле «второй лишний» и у пациентов, и у врача просто нет выбора…
— Скорее, должно быть решение на государственном уровне о необходимости создания стратегического списка препаратов, качество которых должно контролироваться. Потому что нельзя сказать, что и раньше у пациента был выбор: онкологическая помощь в основном относится к категории государственной бесплатной медицины. Очень небольшой процент людей может себе позволить онкологического помощь за счет собственных средств на сегодняшний день. Кто может себе позволить терапию за 21 млн рублей, как в случае с CAR-T?
«Для внедрения нового метода лечения требуется минимум пять лет»
— Как сегодня благотворительность помогает в проведении исследований?
— Спонсирует примерно половину всех исследований в области лечения онкологических заболеваний. И тут есть несколько проблем. Во-первых, академические исследования включают в себя несколько этапов. Для диагностики требуются методы и исследования, которые еще не имеют регистрационных удостоверений. То есть мы не можем тратить на них те деньги, которые выделяет государство. Поскольку такие методы появляются очень быстро — за 2-3 года практически кардинально меняется подход к современной диагностике злокачественных опухолей, — производители этих реагентов не заинтересованы в том, чтобы регистрировать свой продукт, проходить этот длинный путь который занимает около года или дольше. Соответственно, единственный вариант — это благотворительность.
Во-вторых, это все-таки препараты, которые могут применяться вне рамок зарегистрированных показаний, по новым показаниям, или это настолько редкая история, что производители лекарственных средств просто не регистрируют те или иные показания: им экономически невыгодно. И в этом случае мы тоже не можем использовать государственные деньги.
СПРАВКА
Благотворительный фонд AdVita с 2002 года помогает взрослым и детям, которые лечатся от рака в клиниках Петербурга, и онкологическим отделениям больниц.
Задача фонда — сделать современное лечение доступным любому человеку независимо от возраста, уровня дохода, медицинского прогноза. Мы помогаем на всех этапах: от постановки диагноза до завершения лечения. AdVita оплачивает диагностику, лекарства, поиск и активацию доноров костного мозга, оборудование, реагенты и расходные материалы для клиник, поддерживает научные исследования.
Вы тоже можете помочь российским ученым в разработке новых видов терапии и, как следствие, спасти тысячи жизней:
ХОЧУ ПОМОЧЬ— Как происходит внедрение новых методик, если говорить о терапиях онкологических заболеваний: от лаборатории до конкретного врача, который будет применять новую методику?
— Есть два типа клиник — академические и муниципального здравоохранения. Последние, по текущим приказам, не могут сами инициировать какие-то исследования. Поэтому они работают в рамках существующих стандартов лечения и клинических рекомендаций. Академические клиники, под которыми я подразумеваю научные и образовательные учреждения, могут инициировать исследования. И результаты их исследований потом могут лечь в основу национальных рекомендаций, которые мы должны обновлять раз в два года. Уже на основании этих рекомендаций муниципальные клиники применяют новый метод лечения, который показал большую эффективность. Поскольку в России проводится небольшое количество академических исследований, чаще транслируются результаты американских и европейских рабочих групп, которые тоже потом входят в клинические рекомендации и стандарты лечения.
— Как устроена коммуникация между разработчиками методов лечения и практикующими врачами? Может ли условный врач из Самары позвонить в Петербург и спросить: я применяю вашу терапию, у меня что-то идет не так, что делать?
— Вообще мы пытаемся к такому варианту прийти и создать рабочие группы в отношении конкретных проблем в области онкологии и гематологии, где была бы открыта коммуникация между всеми участвующими сторонами. Потому что это известный факт для любой области человеческой деятельности: чем больше коммуникаций, тем лучше результат.
— А сколько времени требуется на полный цикл от начала разработки терапии до ее внедрения?
— Минимум — примерно пять лет, потому что сейчас, конечно, утверждают виды лечения просто по уровню ответов, но чаще всего стандартом является оценка доли пациентов, у которых опухоль не прогрессирует через 2–5 лет. Соответственно нужно подождать, понаблюдать за пациентами и определить, насколько эффективен тот или иной метод.
— Какие направления лечения онкологических заболеваний можно назвать наиболее перспективными?
— Понятно, что будут появляться новые препараты. Следующее поколение препаратов будет основано на активации возможностей собственной иммунной системы человека, и это уже сейчас происходит. У нас буквально каждый год есть новый препарат для какой-то болезни, который использует механизм, который основан на том, чтобы помочь иммунным клеткам справиться с болезнью. Ну и, конечно, будет более активно применяться генная модификация различных клеток организма человека.
— Какую роль в этих разработках занимает российская наука?
— Роль очень серьезно догоняющего участника процесса.
— Что бы вы назвали своей профессиональной миссией?
— Когда я поступал в институт, у меня была одна из таких фантастических идей: попытаться полностью побороть рак. А потом, когда я стал работать, то понял, что это полная утопия. Но в каких-то областях получается сдвинуть эту проблему чуть-чуть дальше. И, пожалуй, это доставляет удовольствие, но и, конечно, любой человек в любой профессии вам скажет, что 90–95% жизни — это рутинная работа.
Читать далее
НАСА предлагает посмотреть фото, которое «Хаббл» снял в ваш день рождения
Эксперты заявили, что на спутниковые снимки попал истребитель шестого поколения
