Трансплантация фекальной микробиоты становится все более популярной. Только в Европе ежегодно выполняется почти 2 тыс. подобных процедур. Многочисленные исследовательские группы из ЕС, США и Израиля постоянно объявляют о том, что с помощью пересадки кала можно бороться со старением, онкологией, болезнями желудка и даже психическими расстройствами. «Хайтек» разбирается, действительно ли мир, наконец, нашел панацею и как она работает.
От неизлечимых кишечных инфекций до метаболического синдрома, от меланомы до синдромов раздраженного кишечника или Туретта: многие заболевания, по данным исследований, потенциально могут быть излечены с помощью трансплантации фекальной микробиоты (ТФМ). Ученые полагают, что пересадка кала может обратить старение вспять и даже предлагают запасать его в юности, чтобы потом бороться с возрастными заболеваниями.
Но действительно ли новый метод терапии способен избавить от всех болезней и универсально хорошо работает для всех? В августе и сентябре 2022 года сразу три независимые научные группы опубликовали результаты исследований, которые описывают динамику микробиома после трансплантации или, говоря простыми словами, оценивают, от чего зависит успех такой терапии.
Как работает пересадка кала?
ТФМ — это передача реципиенту образцов жидкости и бактерий, собранных в нижней части кишечника у донора. Как правило, такую процедуру используют для восстановления нарушенной микрофлоры кишечника пациента и лечения заболеваний, связанных с ней.
Хотя первые записи об использовании донорских фекалий в качестве лечебного средства при пищевых отравлениях и диарее было зарегистрировано в «Справочнике по неотложной медицине» китайцем Хун Ге еще в IV веке, в доказательной медицине этот метод стал популярным сравнительно недавно.
Первое исследование использования трансплантации фекального микробиома было опубликовано в 1958 году Беном Эйземаном и другими хирургами из Колорадо. Они отметили, что использование фекальных клизм помогло вылечить четырех критически больных людей с фульминантным псевдомембранозным колитом. Это тяжелое заболевание толстого кишечника, которое вызывает воспаление и образования на слизистой.
Позже было доказано, что это заболевание вызывает бактерия Clostridium difficile и что ТФМ — один из лучших способов для его лечения. По данным большого количества исследований, при лечении псевдомембранозного энтероколита эффективность ТФМ достигает 90%.
Современные исследования показали, что совокупность всех микроорганизмов в организме человека, микробиом, имеет важное значение для здоровья человека. Изменения в его составе влияют на микробное взаимодействие с организмом человека. Поэтому нарушения в микробной экосистеме кишечника человека связаны со многими метаболическими, воспалительными и инфекционными заболеваниями.
Реципиент важнее донора
Хотя клинические испытания показали, что ТФМ могут эффективно лечить определенные расстройства кишечника, механизм их действия остается неясным. Некоторые предполагают, что кишечные микробиомы доноров обладают полезными свойствами, которые помогают вернуть кишечник реципиента в здоровое состояние. Однако это никогда не изучалось систематически.
В работе, опубликованной в журнале Nature Medicine, исследователи из Европейской молекулярно-биологической лаборатории использовали данные более 300 трансплантаций фекальной микробиоты человека, чтобы получить представление о том, что происходит, когда два кишечных микробиома сталкиваются друг с другом.
Используя клинические и метагеномные данные, исследователи обнаружили, что реципиент, а не донор, в первую очередь, определяет микробный состав, полученный в результате этой процедуры.
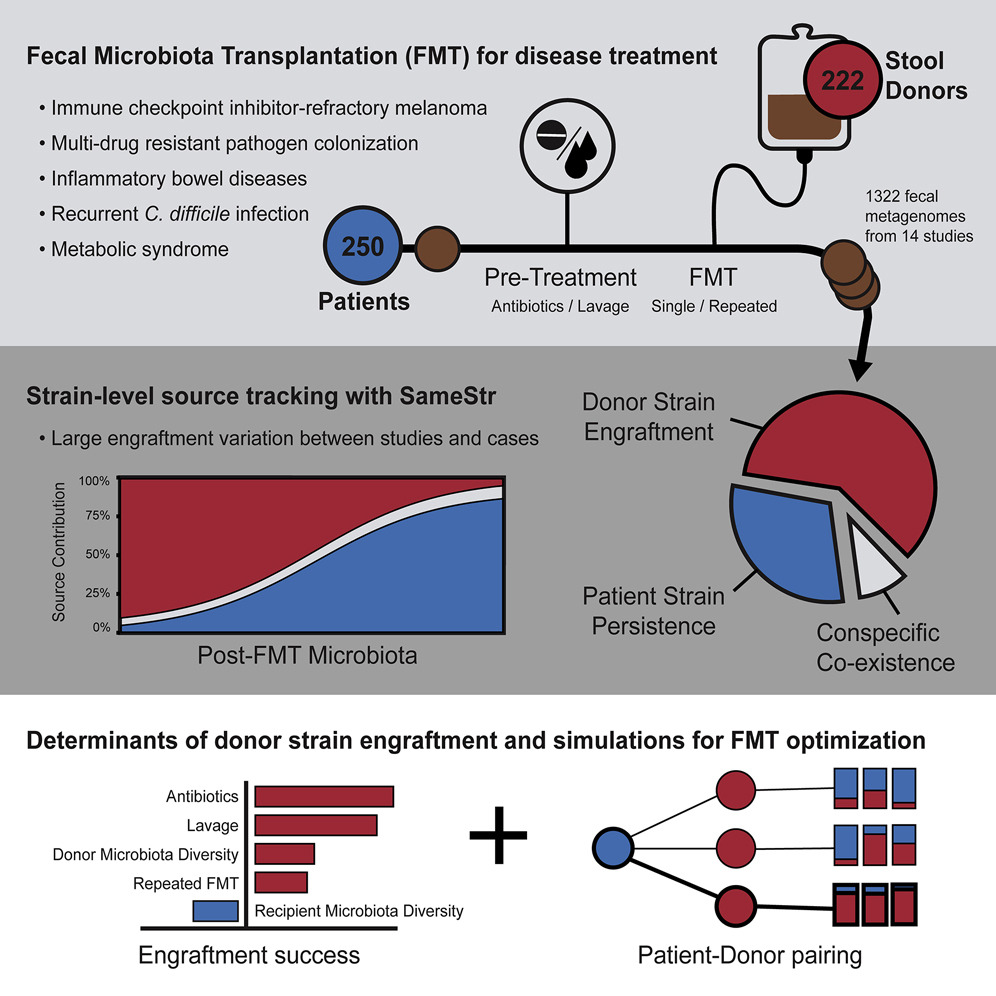
Используя машинное обучение, ученые проанализировали факторы, определяющие микробную динамику после пересадки, включая наличие или отсутствие отдельных микробных видов. Их результаты показывают, что богатство видов (показатель того, насколько разнообразен микробиом кишечника реципиента до трансплантации), а также то, насколько микробиом кишечника реципиента отличается от донора, являются основными факторами, определяющими, какие виды выживут и будут процветать после трансплантации.
Это значит, что универсального донора не существует, полагают исследователи, но для каждого можно подобрать персональное лечение.
Сначала убей — потом лечи!
К похожим выводам пришли исследователи из Университета Хоэнхайма в Германии. В работе, опубликованной в журнале Cell Reports Medicine, они показали, что из двух штаммов одной бактерии, которые существовали до пересадки, выживает только одна.
При проведении исследования ученые использовали специальный метод, чтобы иметь возможность обнаруживать даже небольшие изменения в микробиоме. В дополнение к результатам собственных анализов, они также записали данные 14 других клинических исследований и оценили данные более 250 человек, получивших трансплантацию кала. Особое внимание уделялось передаче отдельных бактерий или штаммов при трансплантации.
Их самый важный вывод: независимо от основного заболевания, после трансплантации для большинства типов бактерий преобладал только один штамм. Больные в основном содержали либо тот же штамм, что и до лечения, либо новый, перенесенный штамм, но лишь в редких случаях смесь. Чем больше существующий кишечный микробиом был поврежден до трансплантации или нарушен предварительной обработкой антибиотиками, тем успешнее могли заселиться донорские микробы.
Исследователи говорят, что эти результаты объясняют разную эффективность в лечении трансплантацией отдельных заболеваний. Например, в случае рецидивирующих инфекций, вызванных бактерией Clostridioides difficile, эффективность достигает 90%, что связано с длительным приемом антибиотиков, которые почти полностью разрушают собственный микробиом реципиента.
С другой стороны, низкая эффективность пересадки при лечении больных воспалительными заболеваниями кишечника язвенным колитом, выраженным ожирением или диабетом, объясняется высокой степенью сохранности собственных бактерий, которые мешают трансплантации.
Вывод простой, отмечают ученые, предварительная обработка антибиотиками и промывание кишечника перед трансплантацией увеличивают вероятность колонизации пищеварительного тракта донорскими бактериями и эффективности лечения.
Персональная медицина
Подобрать правильное индивидуальное лечение поможет ИИ, который разработали ученые из Католического университета в Риме и университета Тренто. В исследовании, опубликованном в журнале Nature Medicine, эксперты проанализировали с помощью сложных методов геномного секвенирования и компьютерного анализа в общей сложности более 1 300 образцов кишечной микробиоты (собранных из фекалий) от доноров и пациентов-реципиентов с восемью различными заболеваниями, в том числе бактериальными расстройствами, меланомой, синдромом раздраженного кишечника и синдромом Туретта.
Исследователи также обнаружили, что пациенты, получавшие антибиотикотерапию до процедуры трансплантации, имели более высокое приживление. Кроме того, введение микробиоты несколькими путями (например, капсулы вместе с колоноскопией) повышало эффективность лечения.
Ученые показали, что с помощью искусственного интеллекта можно с высокой точностью предсказать состав донорской микробиоты после трансплантации, и это может затем привести к выявлению лучших доноров, чьи фекалии будут более успешны при индивидуальной пересадке.
Панацея?
Некоторые исследователи полагают, что трансплантация кала может выступать в качестве универсального лекарства, которое поможет почти от любых проблем. Например, существует множество исследований, сообщающих о том, что у людей с психическими заболеваниями другой микробиом, и предположение, что ТФМ может облегчить некоторые симптомы, связанные с ними.
Но большинство выводов в этой области основаны на экспериментах, проведенных на модельных организмах, как правило, на лабораторных мышах. Хотя лабораторные мыши довольно умны, многие из «мышиных моделей психических заболеваний» противоречивы. Некоторые исследователи ставят под сомнение тот факт, что у мыши может быть депрессия или пограничное расстройство личности так же, как у человека. Поэтому говорить об универсальном решении, пока слишком рано.
Тем не менее большой прогресс в изучении ТФМ и дальнейшие исследования, возможно, покажут, что спектр возможных применений подобной терапии гораздо шире, чем представляется сегодня.
Читать далее:
Катапульта отправила в небо спутники НАСА