Исследователи показали, как полимиксины разрушают внешнюю «броню» кишечной палочки. Бактерии покрываются бугорками, сбрасывают мембраны, и антибиотик проникает внутрь, убивая клетку.
Ученые впервые смогли наблюдать, как антибиотики убивают бактерии в мельчайших подробностях. Они снимали действие полимиксинов на E. coli — кишечную палочку — в режиме реального времени.
Полимиксины заставляют внешнюю мембрану бактерий формировать крошечные бугорки и вздутия. Когда бугорки разрастаются, клетка сбрасывает поврежденную мембрану, и антибиотик проникает внутрь. После этого бактерия погибает.
«Было невероятно наблюдать действие антибиотика на поверхность бактерий в реальном времени», — отметила Каролина Боррелли из Университетского колледжа Лондона, соавтор исследования.
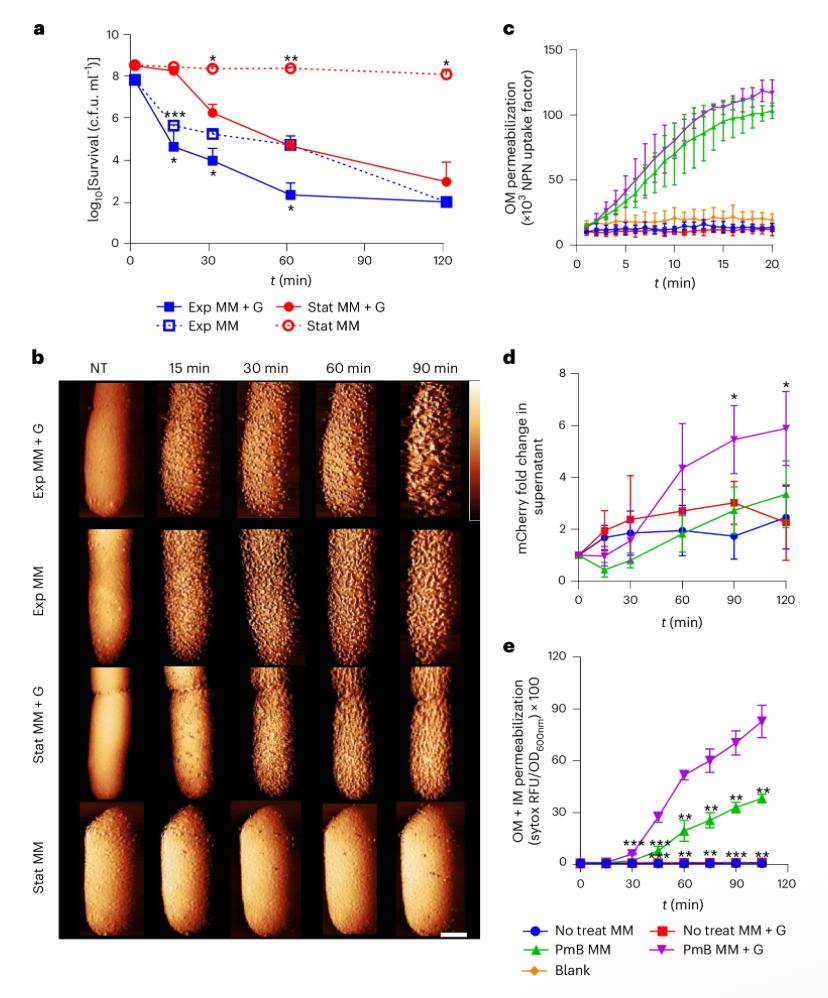
b, Фазовые изображения клеток методом атомно-силовой микроскопии (AFM) при 2,5 µг/мл PmB ± глюкоза в зависимости от времени. Масштаб — 250 нм; цветовая шкала фаз: 6° (ряд 1), 4° (ряд 2), 5° (ряды 3–4). Все клетки, кроме стационарных без глюкозы, к концу наблюдения были SYTOX-положительными. «Фаза» в градусах отражает сдвиг колебаний кантилевера AFM.
c, Нарушение внешней мембраны (OM) стационарных клеток в первые 20 мин воздействия 4 µг/мл PmB, оцененное по поглощению красителя NPN.
d, Выход флуоресцентного белка mCherry из E. coli PerimCherry ± PmB, отражающий нарушение OM.
e, Совместное нарушение OM и внутренней мембраны (IM) стационарных клеток по поглощению красителя SYTOX green. RFU — относительные единицы флуоресценции; контроль («blank») — флуорофор в среде без бактерий. «No treat MM» — минимальная среда без ПмБ; «No treat MM + G» — минимальная среда с 0,36 % глюкозы без ПмБ. Все эксперименты проведены трижды; погрешности отражают стандартное отклонение среднего. Статистическая значимость оценена двухфакторным ANOVA с повторными измерениями: *P < 0,05; **P < 0,01; ***P < 0,001; ****P < 0,0001.
Источник: Nature Microbiology
a, Survival of exponential-phase (Exp) or stationary-phase (Stat) E. coli exposed to 4 µg ml−1 PmB in MM ± glucose, as determined by c.f.u. counts. b, AFM phase images showing exponential- or stationary-phase E. coli cells exposed to 2.5 µg ml−1 PmB in MM ± glucose, shown as a function of time. Scale bar, 250 nm. Colour phase scale (scale insert in first row of image at t = 90 min), 6 degrees (row 1), 4 degrees (row 2), 5 degrees (rows 3 and 4). Except for stationary-phase cells without glucose, all bacteria were SYTOX positive by the end of the imaging (Supplementary Fig. 6a). It is worth noting that a lower PmB concentration was used for AFM relative to other experiments, due to the low density of cells used in these assays. The ‘phase’ in degrees represents the shift in the phase of oscillation of the AFM cantilever. c, OM disruption of stationary-phase E. coli cells during the first 20 min of exposure to 4 µg ml−1PmB, as determined by uptake of NPN fluorescent dye. d, OM disruption of E. coliPerimCherry as determined by egress of the fluorescent protein mCherry into the culture supernatants of stationary-phase bacteria exposed or not to 4 µg ml−1 PmB in MM ± glucose. e, Combined OM and IM disruption of stationary-phase E. coli exposed to 4 µg ml−1PmB in MM ± glucose, as determined by uptake of the fluorescent nucleic acid dye SYTOX green. RFU, relative fluorescence units. For cand e, the blank value refers to the relevant fluorophore in medium without bacteria. For cand e, ‘No treat MM’ refers to the absence of PmB in minimal medium; ‘No treat MM + G’ refers to the absence of PmB in minimal medium containing 0.36% glucose. All experiments were replicated in n = 3 independent assays. Error bars show the standard deviation of the mean. Significant differences were determined between stationary-phase MM + G with PmB and each of the other conditions by two-way repeated measures ANOVA. *P < 0.05; **P < 0.01; ***P < 0.001; ****P < 0.0001.
Source: Nature Microbiology
Исследователи отметили, что речь идёт о грамотрицательных бактериях — у них есть две мембраны, которые защищают клетки от антибиотиков. В эту группу входят кишечная палочка, сальмонелла и шигелла, вызывающая дизентерию.
Полимиксины становятся последней линией защиты против бактерий, которые выработали устойчивость к другим антибиотикам. Биофизик Барт Хугенбум из Калифорнийского университета в Лондоне добавляет: «Важно понять, как они работают, чтобы бороться с опасными инфекциями».
Единственная проблема — антибиотик убивает только активно растущие клетки. Бактерии в состоянии покоя не реагируют на лечение и могут выживать годы без роста и размножения.
Следующая задача ученых — найти способ воздействовать и на «спящие» бактерии, чтобы сделать лечение ещё эффективнее.
Результаты исследования опубликованы в журнале Nature Microbiology.
Читать далее:
Вселенная внутри черной дыры: наблюдения «Уэбба» подтверждают странную гипотезу
Испытания ракеты Starship Илона Маска вновь закончились взрывом в небе
Сразу четыре похожих на Землю планеты нашли у ближайшей одиночной звезды
На обложке: антибиотики из группы полимиксинов заставляют бактерии создавать и сбрасывать свою внешнюю «броню», оставляя пространство, через которое антибиотик проникает и убивает клетку. Источник изображения: © Imperial College London | Nature Microbiology
Antibiotics called polymyxins force bacteria to produce and shed their outer «armor,» leaving space for the antibiotic to then infiltrate and kill the bacterial cell. (Image credit: © Imperial College London Nature Microbiology)




