Фекальная трансплантация — это новый метод лечения, он помогает при бактериальных инфекциях и воспалениях в кишечнике. Ученые считают, что она замедляет старение, помогает при психических расстройствах и даже онкологии. В Европе проводят 2 тыс. процедур в год, но и в России этот метод становится все более популярным. «Хайтек» вместе с благотворительным фондом AdVita поговорил с анестезиологом-реаниматологом Олегом Голощаповым и узнал, действительно ли эта терапия способна избавить от болезней и универсально хорошо работает для всех.
9 сентября 2015 года врачи НИИ ДОГиТ им. Р. М. Горбачевой впервые применили метод трансплантации фекальной микробиоты для лечения поражения кишечника, которое возникает из-за трансплантации костного мозга. Теперь этот метод признали эффективным и применяют в практике клиники. Олег Голощапов — заведующий ОРиИТ № 3 НИИ ДОГиТ им. Р. М. Горбачевой и руководитель исследовательской группы, которая работала над методом.
Частичка здорового донора
— Какую проблему решает метод трансплантации фекальной микробиоты?
— Метод появился в 1958 году, когда американский хирург Бен Эйсман с помощью пересадки кала вылечил четырех пациентов с псевдомембранозным колитом. Метод возродился из-за новых способов диагностики, например, 16S-секвенирования. До середины 90-х считали, что в кишечнике живут десятки бактерий. А с приходом этого метода оказалось, что их там тысячи видов в разных соотношениях. И у каждого человека индивидуальный состав микробиоты. Зная это, мы решили попробовать применить метод трансплантации фекальной микробиоты при реакции «трансплантат против хозяина» (РТПХ).
Секвенирование гена 16S рРНК использует данные о нуклеотидных последовательностях выделенных чистых культур. Ген 16S рРНК выбран как универсальный маркер для видовой идентификации: он есть в геномах всех прокариот и обладает сравнительно малой изменчивостью. Метод секвенирования гена 16S рРНК является «золотым стандартом» точности видовой идентификации бактерий.
Трансплантация фекальной микробиоты призвана улучшить результаты терапии РТПХ с поражением кишечника. Сначала мы исследовали, что происходит с микробиотой у пациентов с РТПХ ЖКТ. По сравнению с периодом до ТГСК (трансплантация гемопоэтических стволовых клеток) качественный и количественный состав микробиоты значительно меняется. Резко снижается количество активно-метаболизирующих, анаэробных бактерий, а количество бактерий, которые вызывают воспаление, — увеличивается, появляется выраженный дисбаланс биологической экосистемы. Возникло предположение: можем ли мы поменять этот дисбаланс трансплантацией микробиоты от здорового донора?

— В чем разница между РТПХ кишечника и другими воспалительными заболеваниями кишечника, которые лечатся тем же методом?
— В причинах появления. Воспалительные заболевания кишечника (ВЗК) — генетически детерминированные изменения иммунной системы. Это врожденные изменения, которые проявляются со временем. А РТПХ — это последствие трансплантации костного мозга, при котором человеку пересаживают чужую иммунную систему. После трансплантации в организме пациента появляются новые иммунные клетки, которые «борются» с тканями в незнакомом организме, — это и есть реакция трансплантат против хозяина, РТПХ.
Одновременно с этим протекает реакция трансплантат против опухоли: новые иммунные клетки находят и уничтожают оставшиеся раковые клетки. Во многих случаях это нужный для организма пациента процесс при условии надежного медикаментозного контроля. При этом клиническая картина РТПХ с поражением кишечника действительно очень похожа на ВЗК. И гистологическая картина схожа, и терапия.
Олег Голощапов окончил медицинское училище в Армавире в 1989 году и Санкт-Петербургскую Педиатрическую Медицинскую Академию в 1995 году. Стажировался и работал в Германии и Австрии. В 2021 году защитил кандидатскую диссертацию по теме «Роль фекального кальпротектина и коррекции микробиоты в диагностике и терапии острой реакции трансплантат против хозяина желудочно-кишечного тракта после аллогенной трансплантации гемопоэтических стволовых клеток крови».
В 2017–2020 годах врачи гематологи и реаниматологи НИИ ДОГИТ им. Р. М. Горбачевой и Детского научно-клинического центра инфекционных болезней провели исследование, в котором оценили клиническую эффективность метода трансплантации фекальной микробиоты (ТФМ) при тяжелых поражениях кишечника у пациентов после трансплантации костного мозга.
В 2022 году группа врачей, которая работала над улучшением и внедрением метода ТФМ в постоянную практику клиники, получила премию «Призвание» за изобретение нового метода лечения.
Последний шанс для спасения
— Как вы пришли к новому методу?
— Мы основывались на принципах офф-лейбл. Если состояние пациента тяжелое, традиционные средства, которые применяются в терапии, не помогают, динамика отрицательная, то применяется метод, который помогает другой категории пациентов в схожей ситуации. Например, мы знаем, что при клостридиальной инфекции (инфекция, вызванная бактерией Clostridium difficile) традиционный метод лечения — трансплантация фекальной микробиоты. Почему бы и не попробовать, если другие методы — иммуносупрессия, пробиотики, антибактериальная терапия — не работают? Мы первые в России провели трансплантацию 10-летней девочке. До этого девочку безуспешно лечили в течении полугода и прогноз был сомнительный.
— Как эта процедура технически проходила в первый раз?
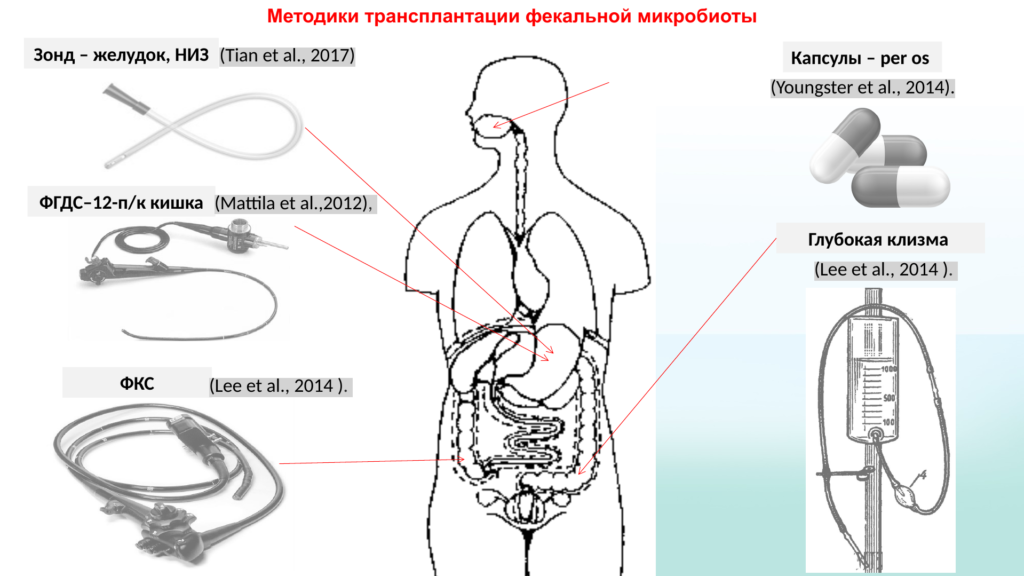
— Мы были крайне не подкованы технически. Вводили трансплантат методом ФГДС через рабочий канал эндоскопа за двенадцатиперстную кишку и методом колоноскопии до слепой кишки.
— Что изменилось с тех пор?
— Абсолютно все — например, методы введения трансплантата. Есть традиционные пути доставки — через верхний отдел желудочно-кишечного тракта (с помощью гастроскопа) и через нижний (колоноскоп, восходящая клизма). Клинический эффект при этом примерно одинаковый, но при инструментальных методах введения чаще возникают осложнения — перфорации, рвота, регургитации, пневмонии. Поэтому мы решили пойти по другому пути, чтобы не было наркоза и инструментальных инвазивных методов доставки. Так родилась идея доставки методом перорального приема замороженных капсул, которые содержат микробиоту.
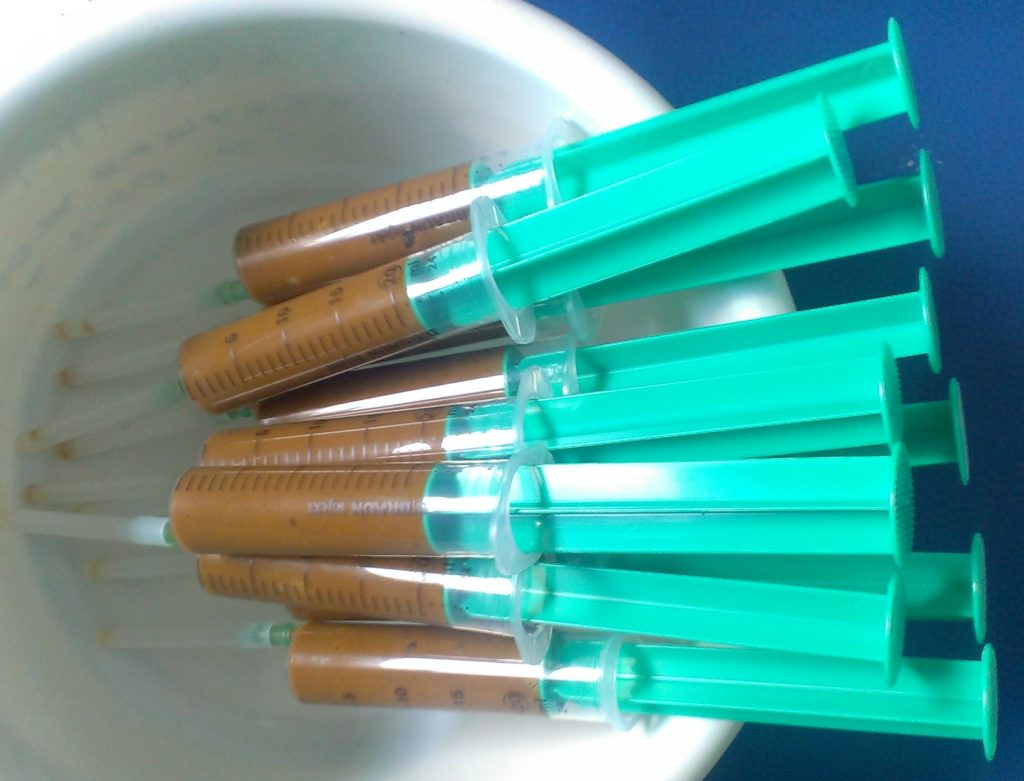
Сначала возник вопрос, где готовить трансплантат, у нас в клинике мы это не делаем. Мы связались с лабораторией, с которой проводили совместные исследования фекального кальпротектина, договорились делать трансплантат у них. Сначала это был путь проб и ошибок, дальше технологии проверялись и отрабатывались. Трансплантат первое время привозили в шприцах, и его нужно было вводить через зонд или ФГДС в течение шести часов после изготовления. И только потом родилась идея с капсулами и заморозкой. Мы провели множество экспериментов, разработали целую схему добавления криопротекторов к бактериям для того, чтобы они не разрушались при криоконсервации. Так мы получили очень хорошие результаты при размораживаний и дошли до капсул.
Для создания трансплантата в капсулах используют донорский кал. Доноры — добровольцы, которых проверяют на совместимость с пациентом по результатам анализов крови и состава микробиоты. Донорский кал смешивают с глицеролом и стерильным сахарным сиропом, затем помещают в двойные твердые желатиновые капсулы. Капсулы упаковывают в стерильные контейнеры и помещают в морозильную камеру.
— И теперь применяете только капсулы?
— Да, причем как для взрослых, так и для детей. Единственное, в чем может быть проблема, — детский возраст, младше четырех лет. Самому маленькому ребенку, который принимал капсулу, было четыре года. Нам нужно было убедиться, что он ее не разжует, не вдохнет, а проглотит.
Пришлось попросить лабораторию, чтобы они сделали тренировочные капсулы. Они заморозили физраствор, после чего врачи неделю тренировались, чтобы маленький пациент проглатывал три-четыре капсулы в неделю. Все прошло без осложнений. Но что делать с детьми младше? В этом случае перспективным и безопасным методом введения может быть восходящая клизма.
Дорогие исследования и вклад благотворителей
— Как вас поддерживает фонд AdVita?
— AdVita помогала практически на всех этапах. Что нужно для того, чтобы провести трансплантацию микробиоты? Пациенту нужно сдать платные анализы, потом — получить капсулы. Они тоже платные, но в основном все деньги уходят на обследование донора — его нужно обследовать очень основательно, и на это уходят колоссальные деньги. Поэтому после того, как мы сообщаем пациенту, что нужно провести исследование, мы спрашиваем, зарегистрирован ли пациент в фонде. Если да, все сильно упрощается. Посттрансплантационное исследование фекалий пациента — тоже AdVita. И, опять же, секвенирование — это очень дорогое исследование. И здесь тоже помогла AdVita, благодаря такой поддержке мы продвинулись именно в науке в плане исследования состава микробиоты в ходе ТФМ.
— По количеству публикаций есть ощущение, что вы массово применяете этот метод.
— Это не массовое применение, есть много противопоказаний. Процедуру нельзя проводить у пациентов после ТГСК, у которых в периферической крови еще не восстановились лейкоциты (гранулоциты и лимфоциты). Иммунитет должен быть, потому что введение большого количества микробов может дать инфекционные осложнения.
Исключаются пациенты с полиорганной недостаточностью — печеночной, почечной, дыхательной. Это не таблетка, которая лечит от всего. Ну и комплаентность (приверженность пациента к лечению, степень готовности выполнять назначения и рекомендации врача) пациента играет большую роль. Если пациент сомневается в эффективности, — мы не проводим процедуру.
— По масштабам подготовки и порядку назначения похоже на трансплантацию костного мозга. Это сравнимо?
— Абсолютно сравнимо. Есть пакет документов, информированное согласие. На первый визит пациент приходит и знакомится с новым методом терапии, желательно с родственниками. Пациенту рассказывают о принципах метода терапии, подробно объясняют побочные и нежелательные явления, которые могут возникнуть. На что нужно обращать внимание, что допустимо, что недопустимо. Пациент берет на это согласие, изучает дома, смотрит открытые источники и принимает решение.

— Какой сейчас статус в работе над методом в вашей практике? Ждет ли от вас чего-то научное сообщество?
— Мне не нравится рутина. Разумеется, мы берем наших пациентов, вот сейчас у нас их три или четыре, которые получили терапию месяц назад. Но если применять метод только в терапевтических целях и не исследовать дальше, то все будет достаточно скучно. Нужны новые моменты, которые еще не исследованы, — например, деколонизация резистентных к антибиотикам бактерий, когда у пациентов и РТПХ с поражением кишечника и Klebsiella pneumoniae (бактерия, которая вызывает острые поражения кишечника и дыхательных путей) в кишечнике.
Мы отправляем отчеты о наших пациентах в группу, которая занимается трансплантацией микробиоты при Европейской ассоциации трансплантации костного мозга (EBMT). Эта группа собирает данные, куда включены все проведенные трансплантации микробиоты пациентам с РТПХ по всем клиникам. И публикует системные обзоры — большие статьи, где рассказывается про метод, побочные явления, эффективность и прочее. И мы здесь не на последнем месте, потому что у нас, в отличие от единичных случаев применения в других странах, прямо рандомизированное клиническое исследование получилось.
— Какие специалисты разрабатывали этот метод вместе с вами?
— В нем участвуют сразу много специалистов. Сотрудники лабораторий подбирают и обследуют донора, делают капсулы. Доктора-гематологи наблюдают за пациентами и выносят их на консилиум, где обсуждают потенциальную трансплантацию микробиоты. Бактериологи устанавливают, колонизирован ли пациент патогенной флорой. Молекулярные биологи изучают состав микробиоты на различных этапах трансплантации. Биоинформатики, которые потом делают заключение по результатам. Это целая команда, благодаря которой метод из обычного стал перспективным.
Читать далее:
Живые организмы сделали Марс непригодным для обитания
Самое мощное столкновение черных дыр во Вселенной доказало теорию Эйнштейна
Кости в пещере «Полуночного ужаса» тщательно изучили и нашли там необъяснимые следы