Компания Verve Therapeutics в 2022 году объявила о начале клинических испытаний использования CRISPR для снижения риска развития у людей сердечно-сосудистых заболеваний. «Хайтек» рассказывает, как работает редактирование генома, почему его можно использовать не только для лечения генетических заболеваний и когда технология может стать массовой.
Сердечно-сосудистые заболевания — основная причиной смерти во всем мире. Всемирной организации здравоохранения считает, что ежегодно на Земле они уносят жизни около 17,9 млн человек. Это значит, что примерно каждая третья смерть в мире связана с проблемами с сердечно-сосудистой системой, при этом около 85% из них вызваны инфарктами и инсультами.
Аналогичная ситуация складывается и в России. По данным Росстата, в 2021 году (данные за 2022 год пока отсутствуют) от заболеваний системы кровообращения в стране умерли 933,8 тыс. человек. Это 38% от общего числа умерших за год — 2,44 млн. человек. До начала пандемии коронавирусной инфекции в 2019 году доля таких заболеваний была еще выше: 47% или 841,2 тыс. из 1 798,3 тыс. смертей.
В такой ситуации неудивительно, что медицинские организации и исследовательские институты по всему миру ищут новые способы профилактики, предотвращения и лечения заболеваний сердечно-сосудистых заболеваний. Все знают, что здоровый образ жизни — сбалансированное питание, регулярные физические упражнения и снижение стресса — сокращают риск развития таких заболеваний. Но Verve Therapeutics предлагает пойти дальше: один укол, который изменит ДНК, чтобы обеспечить пожизненную защиту.
Что такое CRISPR?
CRISPR-Cas9 — один из самых известных на сегодняшний день способов генетического редактирования. Он позволяет отключать и удалять отдельные гены или заменять их участки. Теоретически, это идеальный инструмент для лечения заболеваний путем постоянной коррекции вредных базовых мутаций или разрушения генов, вызывающих заболевание, с высокой точностью и эффективностью.
Метод, который используют ученые, не искусственный. Система CRISPR-Cas9 в процессе эволюции развилась у бактерий и архей в качестве защитного механизма от фаговой и плазмидных инфекции — заражения вирусом или плазмидами. Исследования микроорганизмов показало, что их ДНК содержит повторяющиеся участки, которые назвали CRISPR. По своей сути, это «база данных примет» известных вирусов, с которыми ранее сталкивалась эта бактерия или ее «предки».
При первом взаимодействии с вирусом бактерии сохраняют в ДНК фрагменты его генетического материала. Для активации иммунитета CRISPR работает со специальными белками — Cas. При повторном взаимодействии с вирусом, геном которого гомологичен (схож) с тем, что содержится в «базе данных», клетка активирует транскрипцию области CRISPR. В результате серии биологических процессов формируется направляющая РНК и белок — эндонуклеаза, которые находят чужеродные области вирусного генетического кода и разрушают его.
Как с помощью CRISPR-Cas9 редактировать гены?
Система CRISPR-Cas9 напоминает крошечные ножницы. Они состоят из двух элементов: направляющей РНК, которая «говорит» участки с какой последовательностью нуклеотидов необходимо разрушить, и белка Cas9, который выполняет «надрез» двух цепочек ДНК в нужном месте. Изменяя нуклеотидную последовательность небольшого сегмента направляющей РНК, такие ножницы можно нацелить почти на любой нужный участок гена. После выполнения разреза активируются естественные механизмы восстановления ДНК, которые «сращивают» молекулу, что, как правило, устраняет вредную мутацию.
Недостаток этого метода связан с тем, что многочисленные разрывы двухцепочечной ДНК приводят к новым мутациям, которые вызывают побочные эффекты от терапии. Например, израильские ученые проанализировали использование CRISPR/Cas9 для лечения одного из видов рака и показали, что помимо позитивного результата, перестройка генома ставит под угрозу стабильность ДНК, что впоследствии может привести к другим онкологическим заболеваниям.
Исследователи активно работают над оптимизацией метода, чтобы сохранить полезные эффекты и не нанести вред пациенту. Например, для этого можно использовать не Cas9, а другой белок, который аккуратно разрезает только одну из двух нитей ДНК.
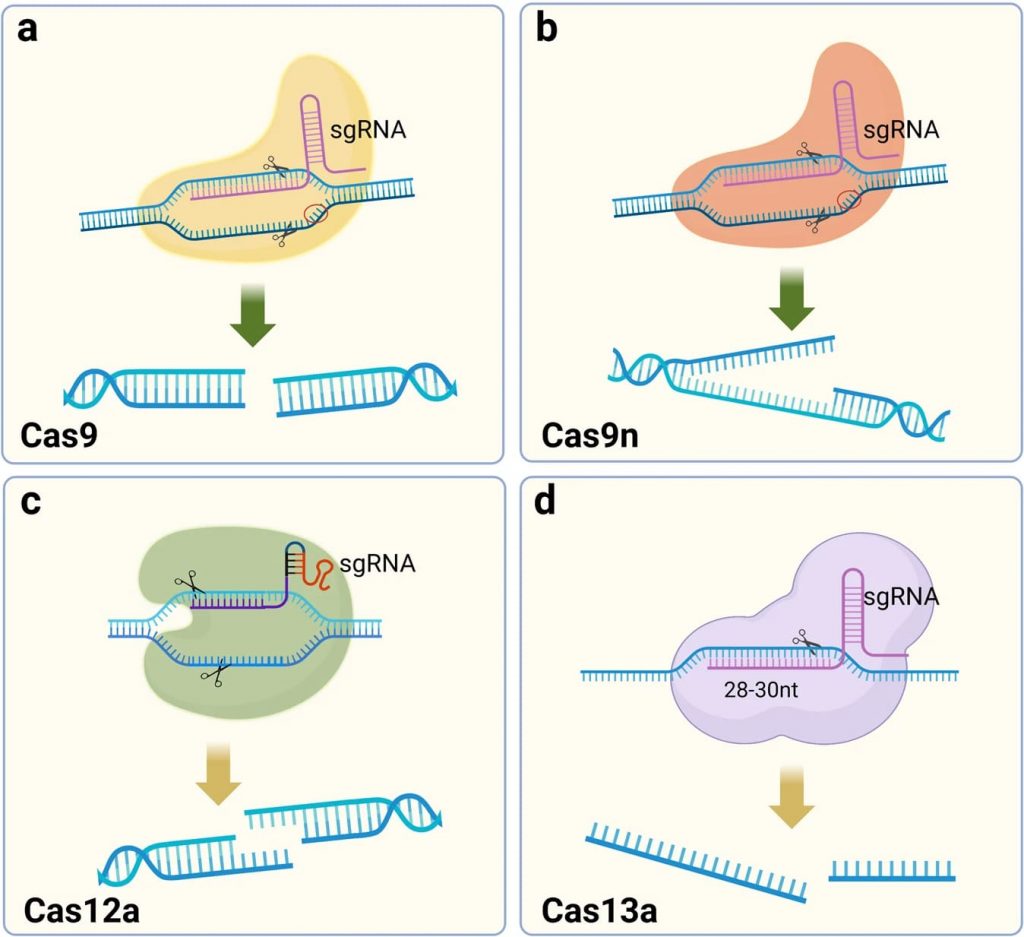
Если первоначально CRISPR использовался только для того, чтобы просто делать надрезы в ДНК. Сейчас исследователи тестируют возможность использования модернизированной технологии для активации и деактивации отдельных генов, или вставки совершенно новых фрагментов ДНК в геном. При этом новые формы редактирования работаю несколько иначе.
Например, технология базового редактирования (base editing) вместо разрезания использует замену одного нуклеотида (азотистого основания) в молекуле на другой. С помощью этого подхода можно заменить связку оснований «цитозин — гуанин» в заданном месте ДНК на пару «тимин — аденин» и наоборот.
Как снизить риск сердечно-сосудистых заболеваний?
Наиболее очевидное применение генетического редактирования в медицине — лечение заболеваний, которые вызваны мутациями в генах. Но на самом деле возможности гораздо шире, считают в Verve Therapeutics. Например, они предлагают отключать у людей один из генов, который кодирует белок, влияющий на уровень холестерина в крови.
Одна из распространенных причин развития сердечно-сосудистых заболеваний — атеросклероз. Нарушения, связанные с белково-липидным обменом, приводят к отложению внутри сосудов холестерина, который препятствует нормальному току крови. По мере развития атеросклеротическая бляшка может вызывать тромбоз, приводить к инфарктам и инсультам.
При недостатке холестерина клетки производят специальные рецепторы липопротеина низкой плотности, которые захватывают это вещество из крови. Один из генов, отвечающих за уровень холестерина — PCSK9. Он регулирует производство одноименного белка, который разрушает такие рецепторы. Исследования показали, что деактивация этого гена приводит к снижению уровня холестерина в крови и риска развития сердечно-сосудистых заболеваний.
Один укол снижает уровень холестерина
Verve Therapeutics использует замену одного основания аденин (A) на гуанин (G) в определенном участке гена PCSK9, чтобы нарушить выработку одноименного белка. Лекарство состоит из матричной РНК (мРНК) и гидовой РНК (гРНК), упакованных в липидную наночастицу (ЛНП). Лекарство вводится через вену в кровь. Наночастицы усваиваются клетками печени, связка на основе мРНК и гРНК сканирует ДНК и заменяет одно из оснований.
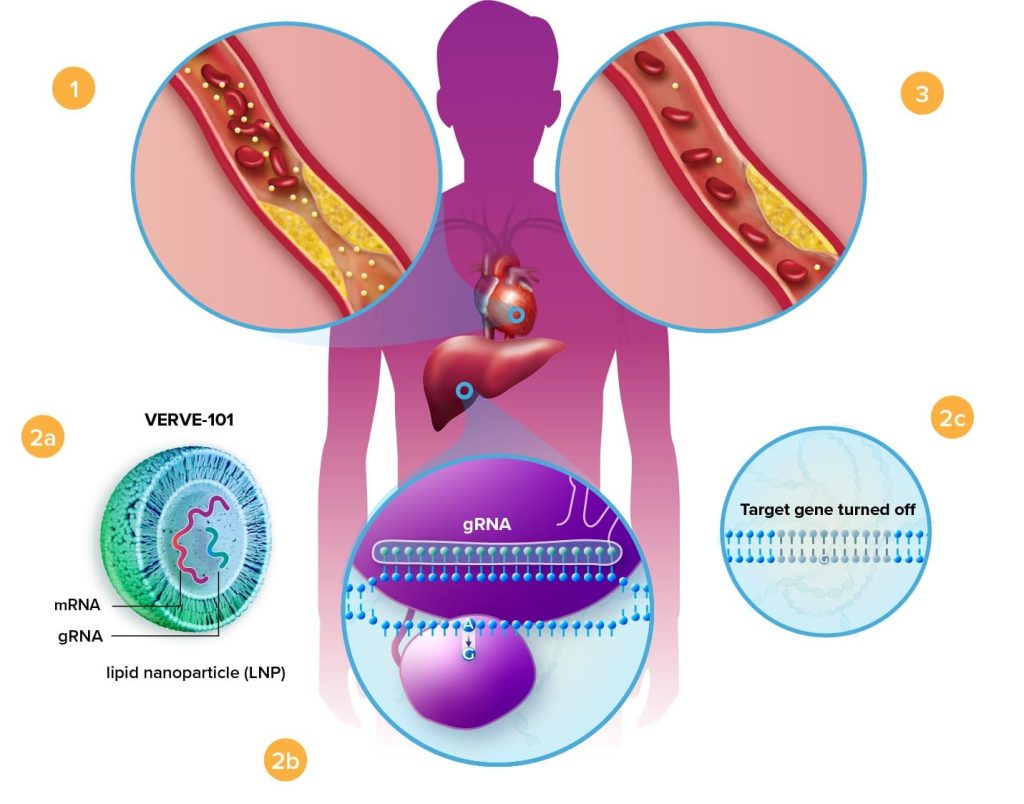
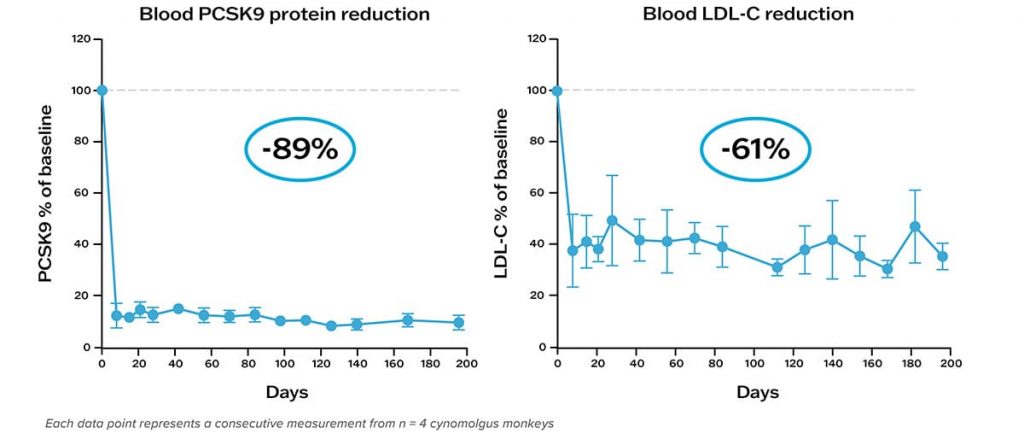
Эксперименты на приматах показали, что у обезьян, которые получили лекарство, в течение нескольких дней после укола уровень холестерина в крови снижался примерно на 60-70%. При этом достигнутый результат сохранялся, как минимум, в течение восьми месяцев.
Для первой фазы клинических испытаний в Verve Therapeutics выбрали людей, у которых диагностировано генетическое заболевание — гетерозиготная семейная гиперхолестеринемия. Это генетическая мутация, которая подавляет экспрессию рецепторов липопротеина низкой плотности, а потому в крови накапливаются аномально высокие уровни холестерина.
В компании объясняют свой выбор необходимостью соблюдать осторожность при тестировании нового метода: у добровольцев, включенных в первую фазу испытания, уже есть склонность к атеросклерозу и болезни сердца, а потому рискованная терапия оправдана. Если испытания пройдут успешно, в компании планируют расширить как спектр генов, которые можно отключить, так и спектр возможных пациентов.
В перспективе такой подход может привести к всеобщей вакцинации и не только от склонности к развитию атеросклероза, но и, например, от сахарного диабета. Одновременно в компании отмечают, что для этого потребуется несколько лет.
Стоит отметить, что до настоящего времени ни один метод лечения на основе CRISPR не получил одобрения для массовой терапии и применяются только в клинических испытаниях. Первое подобное решение, как ожидается, американский регулятор (FDA) может принять в 2023 году.
Обновление 29.12.2023: 8 декабря 2023 года FDA впервые одобрило использование генной терапии для лечения пациентов с серповидноклеточной анемией.
Читать далее:
Польза витамина D для профилактики рака зависит от веса человека
Скрытую колонию пингвинов случайно нашли по снимкам из космоса
Гигантское солнечное пятно поворачивается к Земле. Его видно невооруженным взглядом